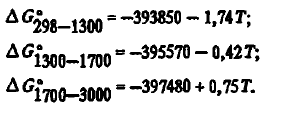Кремний — химический элемент IV группы Периодической системы элементов Д.И. Менделеева. Открыт в 1811 г. Ж. Гей-Люсаком и Л. Тернаром. Его порядковый номер 14, атомная масса 28,08, атомный объем 12,04 • 10-6 м3/моль. Кремний — металлоид, принадлежит к подгруппе углерода. Его валентность по кислороду +2 и +4. По распространенности в природе кремний уступает только кислороду. Его массовая доля в земной коре составляет 27,6 %. Земная кора, по мнению В.И. Вернадского, более чем на 97 % состоит из кремнезема и силикатов. Кислородные и органические соединения кремния входят также в состав растений и животных.
Искусственно полученный кремнии может быть как аморфным, так и кристаллическим. Аморфный кремний — коричневый, тонко дисперсный, сильно гигроскопичный порошок, по рентгеноструктурным данным, состоит из мельчайших кристалликов кремния. Он может быть получен восстановлением при высоких температурах SiCl4 парами цинка.
Кристаллический кремний имеет серо-стальной цвет и отличается металлическим блеском. Плотность кристаллического кремния при 20°С составляет 2,33 г/см3, жидкого кремния при 1723-2,51, а при 1903К – 2,445 г/см3. Температура плавления кремния — 1690 К, кипения — 3513 К. В соответствии с данными, давление паров кремния при Т = 2500÷4000 К описывается уравнением lg pSi = —20130/ Т + 7,736, кПа. Теплота возгонки кремния 452610, плавления 49790, испарения 385020 Дж/моль.
Поликристаллы кремния отличаются высокой твердостью (при 20°С HRC = 106). Однако кремний очень хрупок, поэтому имеет высокую прочность при сжатии (σСЖВ ≈690 МПа) и очень низкое сопротивление разрыву (σВ ≈ 16,7 МПа).
При комнатной температуре кремний инертен, реагирует только со фтором, образуя летучий 81Р4. Из кислот реагирует только с азотной в смеси с плавиковой кислотой. Со щелочами, однако, кремний реагирует довольно легко. Одна из его реакции со щелочами
Si + NaOH + H2O = Na2SiO3 + 2H2
используется для получения водорода. Вместе с этим с неметаллами кремний способен давать большое количество химически прочных соединений. Из подобных соединений необходимо отметить галогениды (от SiX4 до SinX2n+2, где X — галоген, а n ≤ 25), их смешанные соединения SiCl3B, SiFCl3 и др., оксихлориды Si2OCl3, Si3O2Cl3 и др., нитриды Si3N4, Si2N3, SiN и гидриды с общей формулой SinH2n+2, а из соединений, встречающихся при производстве ферросплавов, — летучие сульфиды SiS и SiS2 и тугоплавкий карбид SiC.
Кремний способен также давать соединения с металлами — силициды, наиболее важными из них являются силициды железа, хрома, марганца, молибдена, циркония, а также РЗМ и ЩЗМ. Это свойство кремния — способность давать химически очень прочные соединения и растворы с металлами — широко используется в технике производства низкоуглеродистых ферросплавов, а также при восстановлении легкокипящих щелочноземельных (Са, Mg, Ва) и трудновосстановимых металлов (Zr, Al и др.).
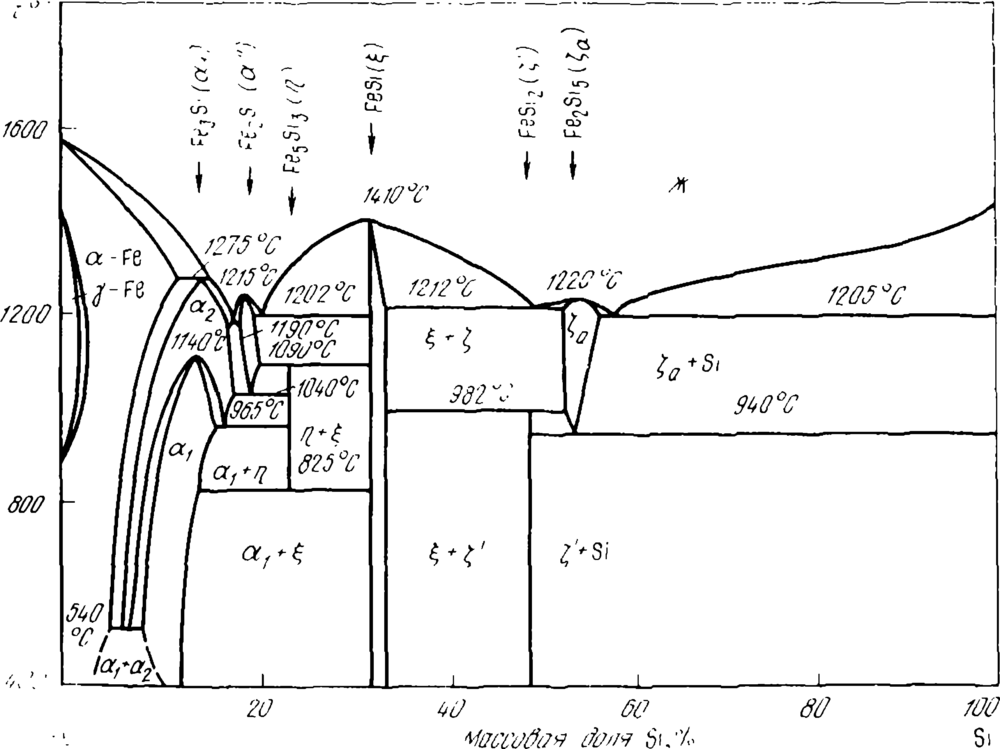
Сплавы кремния с железом изучены П.В. Гельдом и его школой, особое внимание было обращено на часть системы Fe-Si, относящуюся к сплавам с его высоким содержанием. Это связано с тем, что, как видно из диаграммы Fe-Si (рисунок 1), в сплавах этого состава происходит целый ряд превращений, значительно влияющих на качество ферросилиция различных марок. Так, дисилицид FeSi2 стабилен только при низких температурах (2Si5, что практически соответствует максимальной концентрации кремния в лебоите.
При охлаждении сплавов с содержанием > 55,5 % Si лебоит при Т
Fe2Si5 → FeSi2 +Si (2)
а сплавов 33,86—50,07 % Si при Т
Fe2Si5 + FeSi = ЗFeSi2 (3)
Cплавы промежуточного состава (50,15—55,5 % Si) сначала при 1255 К претерпевают перитектоидное (3), а затем при 1213 К — эвтектоидное (2) превращения. Эти превращения Fe2Si5 по реакциям (2) и (3) сопровождаются изменениями объема силицида. Особенно велико подобное изменение в ходе реакции (2) — примерно 14 %, поэтому сплавы, содержащие лебоит, теряют сплошность, растрескиваются и даже рассыпаются. При медленной, равновесной кристаллизации (см. рисунок 1) лебоит может выделяться при кристаллизации как сплава ФС75, так и ФС45.
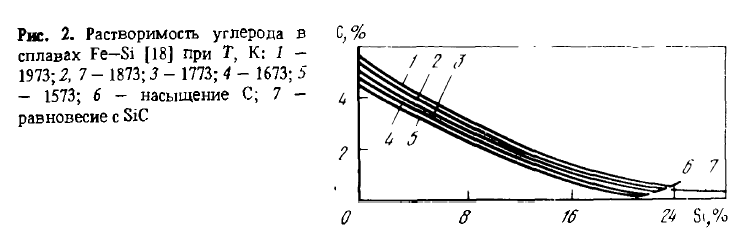
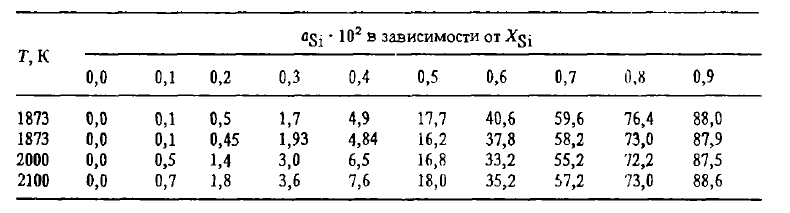
Однако растрескивание, связанное с эвтектоидным распадом лебоита, лишь одна из причин рассыпания. Второй причиной, по-видимому главной, является то, что образование трещин по границам зерна создает возможность ликватам, выделяющимся по этим границам — фосфору, мышьяку, сульфидам и карбидам алюминия и др., — реагировать с влагой воздуха по реакциям, в результате которых в атмосферу выделяются H2, PH3, PH4, AsH4 и т.п., а в трещинах – рыхлые оксиды Al2O3, SiO2 и другие соединения, распирающие их. Предотвратить рассыпание сплавов можно их модифицированием магнием, легированием добавками элементов, измельчающих зерно (V, Ti, Zг и др.) или делающих его более пластичным. Измельчение зерна уменьшает на его границах концентрацию примесей и их соединений и влияет на свойства сплавов так же, как общее понижение в сплаве концентрации примесей (P, Al, Ca), способствующих рассыпанию. Термодинамические свойства сплавов Fe-Si (теплота смешения, активность, растворимость углерода) изучены подробно, их можно найти в работах. Сведения о растворимости углерода в сплавах Fe-Si приведены на рисунке 2, об активности кремния — в таблице 1.
Физико-химические свойства кислородных соединений кремния изучал П.В. Гельд с сотрудниками. Несмотря на важность системы Si—O, ее диаграмма до сих пор не построена. В настоящее время известны два кислородных соединения кремния — кремнезем SiO2 и монооксид SiO. В литературе имеются также указания о существовании и других кислородных соединений кремния — Si2O3 и Si3O4, однако сведения об их химических и физических свойствах отсутствуют.
В природе кремний представлен только кремнеземом SiO2. Это соединение кремния отличается:
1) высокой твердостью (по шкале Мооса 7) и тугоплавкостью (Tпл = 1996 К);
2) высокой температурой кипения (ТКИП = 3532 К). Давление паров кремнезема может бьггь описано уравнениями (Па):

3) образованием большого количества модификаций:
 Особенностью аллотропных превращений SiO2 является то, что они сопровождаются значительными изменениями плотности и объема вещества, что может вызвать растрескивание и измельчение породы;
Особенностью аллотропных превращений SiO2 является то, что они сопровождаются значительными изменениями плотности и объема вещества, что может вызвать растрескивание и измельчение породы;
4) высокой склонностью к переохлаждению. Поэтому имеется возможность в результате быстрого охлаждения зафиксировать структуру как жидкого расплава (стекло), так и высокотемпературных модификаций в-кристобалита и тридимита. Наоборот, при быстром нагревании можно расплавить кварц, минуя структуры тридимита и кристобалита. Температура плавления SiO2 при этом понижается примерно на 100 °С;
5) высоким электросопротивлением. Например, при 293 К оно составляет 1 • 1012 Ом*м. Однако с повышением температуры электросопротивление SiO2 понижается, а в жидком состоянии кремнезем – неплохой проводник;
6) высокой вязкостью. Так, при 2073 К вязкость равна 1 • 104 Па • с, а при 2273 К — 280 Па•с.
Последнее, по мнению Н.В. Соломина, объясняется тем, что SiO2, подобно органическим полимерам, способен образовывать цепочки, которые при 2073 К состоят из 700, а при 2273 К – из 590 молекул SiO2;
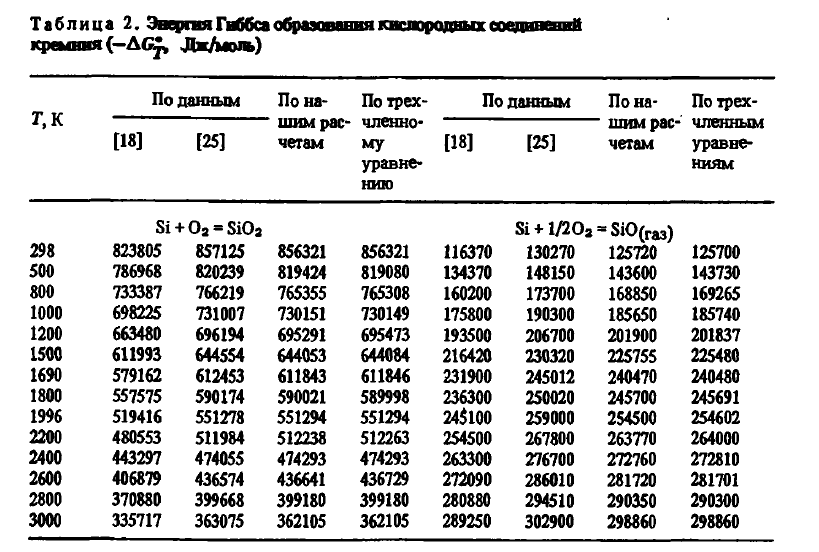
7) высокой термической устойчивостью. Энергия Гиббса образования SiO2 из элементов с учетом агрегатного их состояния в соответствии с данными [3] с высокой точностью описывается уравнениями: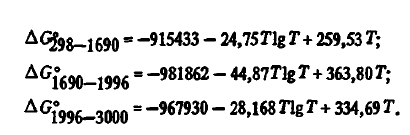
Эти данные, как видно из таблицы 2, несколько отличаются от данных авторов. Для термодинамических расчетов могут использоваться и двухчленные уравнения:
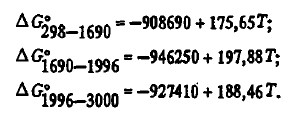
Монооксид кремния SiO обнаружен в 1895 г. Поттером в газовой фазе электропечей. В настоящее время надежно установлено, что SiO существует и в конденсированных фазах. По исследованиям П.В. Гельда, оксид отличается невысокой плотностью (2,15 г/см3), высоким электросопротивлением (105—106 Ом*м). Конденсированный оксид хрупок, его твердость по шкале Мооса ∼ 5. Температуру плавления вследствие высокой его летучести экспериментально определить не удалось. По данным О. Кубашевского, она равна 1875 К, по мнению Бережного, — 1883 К. Теплота плавления SiO в несколько раз выше ΔH0SiO2 по данным она равна 50242 Дж/моль. По-видимому, вследствие летучести она завышена. Имеет стекловидный излом, его цвет изменяется от белого до шоколадного, что связано, вероятно, с его окислением кислородом воздуха. Свежий излом SiO обычно имеет гороховатый цвет с жирным блеском. Термодинамически стабилен оксид только при высоких температурах в виде SiO(Г). При охлаждении оксид диспропорционирует по реакции
2SiO(Г) = SiO(Ж) + SiO2 (6)
Температуру кипения SiO можно ориентировочно оценить из уравнения:
![]()
Газообразный оксид кремния термодинамически очень стоек. Энергию Гиббса его образования можно описать уравнениями (см. таблицу 2):
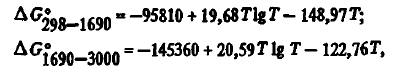
из которых видно, что химическая прочность SiO подобно CO с ростом температуры повышается, что делает его прекрасным восстановителем для многих веществ.
Для термодинамического анализа можно использовать и двухчленные уравнения:
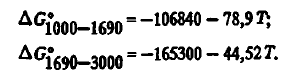 Состав газов над SiO2 оценивался И.С. Куликовым. В зависимости от температуры содержание SiO над SiO2 описывается уравнениями:
Состав газов над SiO2 оценивался И.С. Куликовым. В зависимости от температуры содержание SiO над SiO2 описывается уравнениями:

Карбид кремния, как и SiO, является одним из промежуточных соединений, образующихся в ходе восстановления SiO2. Карбид отличается высокой температурой плавления.
В зависимости от давления он стоек вплоть до 3033—3103 К (рисунок 3). При высоких температурах карбид кремния сублимирует. Однако давление паров Si(Г) , Si2C(Г), SiC2(Г) над карбидом при Т
![]()
Карбид существует в виде двух модификаций — кубической низкотемпературной β-SiC и гексагональной высокотемпературной α-SiC. В ферросплавных печах обычно встречается лишь β-SiC. Как показали расчеты с использованием данных, энергия Гиббса образования описывается уравнениями:
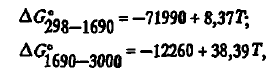
которые заметно отличаются от данных. Из этих уравнений следует, что карбид термически стоек до 3194 К. По физическим свойствам карбид отличается высокой твердостью (~ 10), высоким электросопротивлением (при 1273К p≈0,13 ⋅ 104 мкОм ⋅ м), повышенной плотностью (3,22 г/см3) и высокой стойкостью как в восстановительной, так и в окислительной атмосфере.
По внешнему виду чистый карбид бесцветен, обладает полупроводниковыми свойствами, которые сохраняются и при высоких температурах. Технический карбид кремния содержит примеси и поэтому окрашен в зеленый или черный цвет. Так, зеленый карбид содержит 0,5—1,3 % примесей (0,1—0,3 % C, 0,2—1,2 % Si + SiO2 , 0,05—0,20 % Fe2O3, 0,01— 0,08 % Al2O3 и др.). В черном карбиде содержание примесей более высокое (1—2 %).
В качестве восстановителя при производстве сплавов кремния применяют углерод. Он же является основным веществом, из которого изготавливают электроды и футеровки электропечей, выплавляющих кремний и его сплавы. Углерод довольно распространен в природе, его содержание в земной коре составляет 0,14 %. В природе он встречается как в свободном состоянии, так и в виде органических и неорганических соединений (в основном карбонатов).
Углерод (графит) имеет гексагональную кубическую решетку. Рентгеновская плотность графита 2,666 г/см3, пикнометрическая – 2,253 г/см3. Он отличается высокими температурами плавления (~ 4000 °С) и кипения (~ 4200 °С), повышающимся с ростом температуры электросопротивлением (при 873 К p≈9,6 мкОм⋅м, при 2273 К p≈ 15,0 мкОм⋅м), довольно прочен. Его временное сопротивление на усах может составить 480—500 МПа. Однако электродный графит имеет σв = 3,4÷17,2 МПа. Твердость графита по шкале Мооса ~ 1.
Углерод — прекрасный восстановитель. Это связано с тем, что прочность одного из его кислородных соединений (СО) повышается с ростом температуры. Это видно из энергии Гиббса его образования, которая, как показали наши расчеты с использованием данных, хорошо описывается как трехчленным
![]()
так и двухчленными уравнениями:
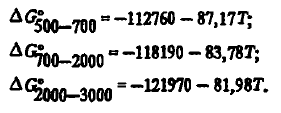
Диоксид углерода СO2 термодинамически прочен лишь до 1300 К. Энергия Гиббса образования CO2 описывается уравнениями: