Химические методы извлечения марганца из бедных руд, некондиционных концентратов, шламов обогащения, металлургических шламов, побочных продуктов смежных производств очень разнообразны и не имеют строгой классификации. Однако наиболее общим признаком следует признать состав химического реагента, используемого для выщелачивания марганецсодержащего сырья. В основу классификации может быть положен вид марганецсодержащего минерала, поскольку каждый из минеральной группы марганца по-своему взаимодействует с тем или иным химическим реагентом.
Независимо от указанных признаков при рассмотрении химических методов обогащения (извлечения марганца) следует иметь в виду, что практически каждой технологической схеме химического обогащения присущи следующие стадии:
- измельчение и помол исходного сырья до классов, обеспечивающих необходимые скорости процесса;
- выщелачивание сырья с переводом марганца в раствор;
- очистка раствора от вредных примесей (прежде всего фосфора) обработкой раствора химическим реактивом с последующей фильтрацией;
- осаждение марганца из очищенного раствора в виде соединений путем воздействия на раствор химическим реагентом или изменением концентрации раствора и выделения соединений марганца выпариванием раствора.
Как в СССР, так и в США велись разработки по выщелачиванию бедных марганцевых руд химическими и гидрометаллургическими методами. Тбилисским химическим институтом АН Грузии выполнен ряд лабораторных и расчетных работ по гидрометаллургии марганца, а также химическому обогащению чиатурских рудных шламов. Строились заводы по обогащению бедных руд в 1942 г. в США., марганцевых руд Невады и Миннесоты, содержащих 12—15 % Mn. В Неваде (Лас Вегас) был построен заводе годовой производительностью
110 тыс. т 60 %-ного концентрата. Руда (псиломелан) выщелачивалась сернистой кислотой, раствор отфильтровывался, очищался от железа и фосфора, фильтрат упаривался с применением многокорпусной вакуум-выпарки. Из-за отсутствия доступной и достоверной информации судьба этого, как и других подобных объектов неизвестна. Следует полагать, что химическое выщелачивание марганцевых руд не получило промышленного применения.
Салли А. отмечает, что химические способы выщелачивания низкосортных руд и шлаков использовали также в Германии в 1939—1945 гг., в США построены опытные установки (а не крупные промышленные комплексы, как это отмечают Ю. В. Клименко и А. П. Квасков) для изучения некоторых из этих способов. Следует полагать, что разработки военных лет в различных странах постигла все та же судьба, что и одного из первых способов химического обогащения марганцевых руд, предложенного Ридманом (Англия) в 1862 г. Сущность этого способа состоит в том, что смесь руды, серной кислоты и сернокислого натрия сушат, плавят, затем к ней добавляют известь и хлорид натрия (или боксит), обжигают и выщелачивают горячей водой. После очистки раствора от никеля и железа его выпаривают до кристаллизации сернокислого натрия. Маточный раствор выпаривают досуха, остаток смешивают с древесным углем и прокаливают в муфельной печи. Затем последовали патенты Херрен — Шмидта и Костебла (получение сернокислых солей марганца), Ридмана (1884 г.) (хлориды марганца разбрызгиваются на горячих плитах в присутствии воздуха с получением оксида марганца и соляной кислоты), Штаадена (1886 г.) (обработка марганцевой руды сернистым газом с получением сернокислого марганца, а последний обменной реакцией с CaCl2 переводится в MnCl2). Затем последовала группа патентов авторов: Деви (1894 г.) (обработка MnO2 раствором сернокислого железа), Чепмана (обжиг карбоната марганца с хлористыми солями), Детт и Детт (окисленная руда в смеси с едкой щелочью обжигается при 600—700 °С в печах в атмосфере воздуха), Ливера (1918 г.) (быстрое растворение различных оксидов марганца в горячей сернистой кислоте, раствор которой получается при пропускании горячего печного газа (2—6 % SiO2) в противотоке к пульпе), Каплана (обработка углекислого марганца воздухом, содержащим пары HNO3 при 300 °С), ван-Арсдаля (пульпу оксидномарганцевой руды продувают сернистым газом с образованием раствора MnSO4 и MnS2O6). В последующие 20—30 годы XX в. появился целый ряд патентов, предметом которых явились процессы (режимы) выщелачивания руды для получения растворов марганца для последующего электролитического получения металлического марганца: процесс Вестлинга (1924 г.) (получение сернокислого марганца), Брадлея (растворение MnO в водных растворах сернокислого аммония, чему предшествует восстановительный обжиг руды), Свита (1929 г.) (аммиачный способ выщелачивания карбонатных руд) и др. К 30-м годам сложилось такое положение, что появлявшиеся новые патенты, по заключению Ю. В. Клименко и А. П. Кваскова, оказались в достаточной степени однообразны и часто отличались друг от друга лишь мало существенными подробностями.
В СССР в 30-е годы также были выполнены работы по созданию технологических схем извлечения марганца из бедного сырья применительно к различным минералогическим разновидностям бедных руд и шламов обогащения. В 1935 г. А. Кобахидзе и Т. Амбокадзе (ТХИ АН ГрССР) на основе метода Брадлея разработали процесс, основными стадиями которого являются восстановление оксидов марганца до MnO газовой смесью СО + Н2 (при > 400 °С) или твердым углеродом (700 °С); быстрое охлаждение восстановленного продукта и хранение его без доступа воздуха; выщелачивание продукта обжига в водных растворах сернокислого аммония (или растворах других химических реагентов, выщелачивающих MnO). Криворучко К. А. и П. М. Каниболоцкий (ДНИГРИ) (1935 г.) изучили выщелачивание шламов обогащения никопольских руд сернокислым аммонием. Работы по выщелачиванию бедных марганцевых руд и шламов в эти годы велись также в Уралмеханобре (А. В. Кирсанов, Ю. В. Квасков, 1934 г.), в Московском химико-технологическом институте (К. М, Салдадзе, 1938 г.), в Ростовском институте прикладной химии (Т. М. Золотых, 1935 г.), в ГИПХе (Я. Е. Сеферович, 1940 г.) и др. В послевоенный период вплоть до середины 60-х годов марганцевая промышленность Украины не проявляла интереса к химическим методам обогащения шламов обогатительных фабрик, так как были восстановлены разрушенные во время войны шахты и карьеры, введены новые мощности как по добыче, так и по обогащению руды. Экстенсивная отработка запасов высококачественных оксидных марганцевых руд сопровождалась образованием огромного количества шламов обогащения, содержащих 10—14 % Mn, а в старых прудах 17—20 % Mn. За годы эксплуатации Никопольского месторождения марганцевых руд в шламохранилищах накопилось свыше 100 млн. т шламов обогащения, содержащих не менее 10 млн. т марганца. Сооружение и эксплуатация шламохранилищ связана с относительно большими затратами. По мере накопления шламов с определенной периодичностью ставится вопрос об отчуждении новых земельных угодий под новые шламоотвалы. С учетом добычи руды механизированными комплексами растет доля пустой породы в сырой руде и, следовательно, удельный выход шламов на единицу товарного концентрата. В связи с быстро сокращающимися запасами оксидных марганцевых руд актуальным становится вопрос о вовлечении в производство марганца как шламов текущего производства, так и накопленного в шламохранилищах. В изложенном аспекте в 70-х годах руководство горнодобывающей подотрасли черной металлургии проявило интерес к различного рода химическим и гидрометаллургическим методам обогащения шламов обогащения марганцевых руд. Главной целью этих работ было стремление уменьшить потери марганца со шламами обогащения и, таким образом, уменьшить капитальные затраты на сооружение новых шахт и карьеров для поддержания достигнутого уровня производства товарных концентратов.
Повышенный интерес к поискам новых химических и гидрометаллургических методов обогащения бедных руд и шламов в последнее десятилетие отмечается и за рубежом в связи с решением проблемы ресурсосбережения. В связи с этим ниже проанализированы новые запатентованные технологические схемы и процессы химического
извлечения марганца из марганецсодержащего сырья.
Серно- и сернистокислотные процессы
Эта группа процессов проанализирована в работах Ю. В. Клименко и А. П. Кваскова, А. Салли, а также в ряде научных сборников и отдельных публикациях. Область применения серно- и сернистокислотных процессов, как и SO2, определяется природой марганецсодержащих минералов в рудах, шламах и шлаках. Если марганец представлен в виде оксида MnO2 (IV), то он сравнительно легко может быть переведен в раствор с использованием указанных серных реагентов. В случае карбонатных разностей марганцевых минералов руду (шламы) необходимо предварительно подвергать прокаливанию для перевода карбонатных соединений в оксидные. По А. Салли, серные процессы не применимы к рудам, в которых марганец присутствует в силикатных формах. Ливер исследовал процесс извлечения марганца из руды путем обработки ее горячей сернистой кислотой, которая получалась при пропускании SO2 через рудный концентрат. Один из вариантов этого процесса с использованием SO2 тщательно был изучен в США, где в 1943 г. фирмой «Manganese Ore Iо» введен в действие завод в штате Невада для переработки 1000 т/сут руды с содержанием 20 % Mn. Из-за больших трудностей этот процесс, как и многие другие, не получил промышленного применения. Отмечен ряд недостатков процесса.
- Образование политианатов (дитионата) марганца по реакции: 2H2SO3 + MnO2 = MnS2O6 + 2H2O, затрудняющих протекание процесса.
- Образование соли серноватистой кислоты между элементарной серой и H2SO3 : S + H2SO3 ↔ S2O32- + 2H+.
- Необходимость поддерживать pH среды ниже 3,5, что уменьшает развитие приведенных выше процессов.
- Образование сульфата кальция, что приводит к зарастанию аппаратуры.
- Необходимость выпаривания раствора и получения сульфата марганца и его обжига при 800—1000 °С.
Одним из недостатков использования сернистого газа и серной кислоты для извлечения марганца из руд и шламов является образование в жидкой фазе побочных соединений MnSO2, Mn (HSO3)2, MnS2O6 и др., затрудняющих дальнейшую переработку. Предложен способ переработки руд, содержащих карбонатные и силикатные минеральные разности с использованием более сильного химического реагента серной кислоты в сочетании с сернистой кислотой, что ускоряет (в 1,5—2 раза) процесс выщелачивания руды. Обработка сырья, содержащего различные формы марганца, переход марганца в раствор в виде MnSO4 протекает по химическим
реакциям:
Mn2+ + H2SO4 → MnSO4 + 2H+;
MnO2 + SO2 → MnSO4;
Mn2O3 + SO2 + H2SO4 → 2MnSO4 + H2O.
В сравнительных опытах оксидно-карбонатную марганцевую руду (23,5 % Mn; 8,2 % Mn4+; 15,3 % Mn2+; 5,8 % CaO; 29,5 % SiO2) выщелачивали чистым сернистым газом (в водной суспензии), а также смесью сернистого газа и сернистой кислоты. Подтверждена более высокая эффективность выщелачивания руды смесью SO2 + H2SO4. Так, степень извлечения марганца в раствор при выщелачивании руды SO2 в течение 30 мин составила ~30 %, а в случае применения смеси SO2 + H2SO4 90 %. Этот способ исключает необходимость предварительного обжига марганецсодержащего сырья. Не требуется расхода реагентов и дополнительных операций по очистке раствора от примесей, поскольку очистка раствора осуществляется нагреванием суспензии до полного разложения избытка сернистой кислоты и удаления выделившегося при этом сернистого газа. «Самоочистка» жидкой фазы, как отмечают разработчики, имеет место, если серную кислоту берут в эквивалентном количестве по отношению к кислорастворимым компонентам руды. В ходе выщелачивания сырья H2SO4 расходуется полностью на реакции, а в суспензии остается избыток только сернистой кислоты.
Если такую суспензию нагреть до 90—100 °С, то H2SO3 разлагается и удаляется, а жидкая фаза без расхода щелочных реагентов имеет pH 3,5—3,8. Благодаря повышению pH среды происходит осаждение соединений фосфора, железа, мышьяка и других нежелательных примесей. Процесс следует вести без доступа воздуха (при низком окислительном потенциале газовой фазы), так как при наличии O2 (разбавлении SO2 воздухом) в процессе выщелачивания при каталитическом действии соединений марганца происходит частичное окисление SO32+ в SO42+ по схеме
Mn2+ + H2SO3 + 0,5O2 → MnSO4 +2H+.
Окисление иона SO32- + 0,5О2 → SO42- при сбалансированных расчетах позволяет уменьшить расход H2SO4 и повысить экономичность процесса. Переработка полученного раствора MnSO4 может вестись известными способами: выпариванием, осаждением (NH4)2CO3 и др. Полученный концентрат после прокаливания при 600—700 °С содержал 65—67 % Mn, 0,002—0,023 % P, 0,001 — 0,14 % S. Обобщены также данные выщелачивания описанным выше способом отвального шлама обогащения оксидных руд (15,5 % Mn, 13,4 % Mn4+, 2,1 % Mn2+, 49,8 % SiO2, 2,9 % CaO, 3,8 % Al2O3) смесью SO2 + H2SO4. Подтверждена высокая степень извлечения марганца как и в случае выщелачивания оксидно-карбонатной марганцевой руды.
Выщелачивание руды травильными растворами
А. Салли описал основные стадии выщелачивания марганцевых руд с использованием образующихся при травлении стальной металлопродукции серной кислотой. Обычно травильные растворы содержат до 10 % H2SO4 и 10—20 % FeSO4. Обработка тонкоизмельченной руды травильным раствором (5 % H2SO4 и 15 % FeSO4) в лабораторных условиях обеспечила 95 % извлечения марганца. Причем лучшие результаты были получены при обработке суспензии газом, содержащим SO2. Несмотря на высокую степень извлечения травильные растворы находятся обычно на большом расстоянии от источников марганцевого сырья, что связано с большими транспортными расходами. И несмотря на это, в различных странах продолжают вести разработку процессов выщелачивания марганцевых руд кислотными растворами с содержанием FeSO4. В этом случае FeSO4 используют как восстановитель Fe2+ + 4Mn4+ → Fe3+ + Mn2+ и как сульфатсодержащий компонент.
Авторы работы изучили выщелачивание марганцевой руды штата Орисса (Индия) синтетическими растворами, моделирующими травильные растворы. При стехиометрическом расходе FeSO4 и Т : Ж = 1 : 10, температуре 90 °С в течение 60 мин извлекалось 90 % Mn. Отмечено, что полученная пульпа фильтруется очень плохо. При добавлении 147 г/л H2SO4 фильтрация улучшается, но в раствор переходит в три-четыре раза больше железа. При обработке руды, предварительно восстановленной углем при 750 °С в течение 1 ч синтетическим травильным раствором, содержащим 170—200 г/л FeSO4 и 92 г/л H2SO4, извлечение марганца повышалось до 99 %.
Во Франции предложен способ извлечения марганца, отличающийся тем, что он облегчает проблему обработки стоков, содержащих FeSO4: их используют при обработке исходного материала, превращая содержащееся в них FeSO4 в Fe (ОН)2. Измельченную марганцевую руду перемешивают с нагретыми до 90 °С раствором FeSO4 до образования осадка, содержащего Fe (ОН)2, и раствором MnSO4. Затем раствор выпаривают при >165 °С до получения кристаллов MnSO4 с последующим прокаливанием их при ∼1000 °С.
В рассмотренных выше разработках основное внимание было сосредоточено на оптимизации параметров выщелачивания марганцевых руд и сплавов, обеспечивающих по возможности наиболее полное извлечение марганца в раствор. Вместе с тем важной является задача определения параметров процесса осаждения марганца из сернокислых растворов с получением осадков заданных составов. В работе исследованы условия осаждения марганца из сернокислотных растворов в процессе индуцированного окисления с получением MnO2. Кинетику осаждения марганца в виде MnO2 оценивали по изменению концентрации в растворе ионов Mn2+ в присутствии молекулярного кислорода и Na2SO3. Последнее соединение обеспечивало парциальное давление SO2 над раствором 0,1—2,0 кПа при pH 4—6 и комнатной температуре. Установлено, что при исходной концентрации ионов Mn2+ 5,2 г/л лучшая степень осаждения достигается при pH 5 (в растворе остается ~ 2 г/л Mn2+). В случае pH 2, а при pH > 5 наряду с MnO2 образуется и Mn2O3. Влияние давления SO2 на скорость и степень осаждения Mn2+ связывают с суммарной реакцией
2Mn2+ + 2H2O + O2 → 2MnO2 + 4H+,
по отношению к которой SO2 играет роль катализатора. Расходование SO2, по-видимому, происходит по реакциям:
SO2 + H2O + ½O2 = 2H+ + SO42- ;
MnO2 + SO2 → Mn+2 + SO42- .
Авторы работы представили результаты селективного извлечения в раствор никеля, кобальта, меди из конкреции (0,56 % Ni, 0,12 % Со, 0,34 % Cu, 13 % Mn и 10,5 % Fe) выщелачиванием их в растворе FeSO4 в присутствии аммиака. Процесс описывается следующими реакциями:
MnO2 + 2FeSO4 + 4NH3 + 2H2O → MnO + 2(NH4)2SO4 + Fe2O3;
MnO2 + 3FeSO4 + 6NH3 + 3H2O → MnO + 3(NH4)2SO4 + Fe3O4;
2MnO2 + 3FeSO4 + 6NH3 + 3H2O → Mn2O3 + 3(NH4)2SO4 + Fe3O4;
Ni3O4 + 3FeSO4 + 18NH3 → 3Ni(NH3)6SO4 + Fe3O4;
Co2O3 + 2FeSO4 + 12NH3 → 2Co(NH3)6O4 + Fe2O3;
2CuO + 2FeSO4 + 6 NH3 + H2O → Cu2(NH3)4SO4 + (NH4)2O4 + Fe2O3.
Японские исследователи разработали сернокислотный способ извлечения марганца из шлака производства ферромарганца. Шлак состава 28 % Mn, 23,4 % SiO2, 16 % CaO, 9,6 % Al2O3 растворяют в H2SO4. Полученный раствор сульфата марганца нейтрализуют до pH 6,0—8,5. После окисления раствора осаждают гидрооксиды железа и других тяжелых металлов. Затем последовательно кристаллизуют CaSO4 и MnSO4. Кристаллы MnSO4 промывают, растворяют в воде и направляют на электролиз для получения металлического марганца.
В работе обобщены результаты извлечения марганца из бедных марганцем шлаков (16 % MnO), как правило, являющихся отвальным продуктом производства ферромарганца. В этих опытах наибольшая степень извлечения марганца (90 %) достигнута при параметрах выщелачивания: Ж : Т = 5 : 1, τ = 30 мин, скорости перемешивания 300 мин-1 и 5,5-кратном избытке H2SO4. Если расходовалось стехиометрическое количество H2SO4, то извлечение составляло всего 28 %. Обращено внимание на необходимость более тонкого измельчения шлака; при 100 %-пом количестве класса от 52 меш извлечение марганца составляло 60 %, а при 100 %-ном
содержании класса от 200 меш извлечение достигало 92 %. В отвальных шлаках силикомарганца и в меньшей мере ферромарганца наряду с оксидной формой содержится до 5—7 % восстановленного марганца в виде запутавшихся частиц корольков силикомарганца (ферромарганца), поэтому химическому извлечению марганца оксидной формы должны предшествовать физические способы улавливания (в жидком состоянии шлака) и выделения из гранулированного шлака этого восстановленного марганца. На НЗФ и ЗЗФ внедрена
воздушная сепарация шлака силикомарганца, обеспечивающая получение продукта — металлоконцентрата, состоящего из частиц силикомарганца до 60—70 % и прилипшей части шлака (до 30—40 %).
Металлоконцентрат в составе основной шихты переплавляется в ферросплавных печах, но может использоваться также и для раскисления и легирования стали. Разработан и промышленно освоен способ извлечения корольков из отвальных шлаков применяемым на обогатительных фабриках методом гидроотсадки. Однако часть корольков сплава, не извлекаемых и этим способом, безвозвратно теряется со шлаками, которые в настоящее время используются в стройиндустрии и дорожном строительстве. Это относится прежде всего к шлаку силикомарганца, поскольку удельные массы сплава и шлака различаются на сравнительно небольшую величину вследствие высокого содержания в сплаве кремния (17—20 %). Кроме того, кислый шлак силикомарганца (47—49 % SiO2, 12—15 % MnO) хорошо смачивает сплав, что затрудняет отделение металла от шлака в процессе выпуска, грануляции и сепарации (отсадки). В этом отношении интересен опыт фирмы «Chromaso», которая завершила строительство цеха обогащения в тяжелых суспензиях на заводе «Beauharnois» (провинция Квебек) по производству ферросилиция. Цех предназначен для извлечения корольков сплава из отвального шлака силикомарганца.
Дитионатный процесс
Сущность процесса состоит в выщелачивании бедной марганцевой руды избытком раствора дитионата, через
суспензию которой пропускается газ, содержащий SiO2. Процесс по А. Салли может быть описан реакциями:
MnO2 + SO2 = Mn2+ + SO42-;
MnO2 + 2SO2 = Mn2+ + S2O62-;
H2O + SO2 + ½O2 = 2H+ + SO42-;
H2O + 2SO2 + ½SO2 = 2H+ + S2O62- .
Образующийся сульфат MnSO4 осаждается в виде CaSO4 при взаимодействии с дитионатом кальция по реакции
Ca2+ + S2O62- + SO42- = CaSO4 + S2O62-.
Отфильтрованный раствор обрабатывают Ca (ОН)2 для осаждения марганца и регенерации дитионата кальция:
Mn2+ + S2O62- + Ca (ОН)2 = Mn (ОН)2 + Ca2+ + S2O62- .
Обжиг Mn (ОН)2 при 800—900 °С приводит к получению металлургического концентрата с высоким содержанием марганца, сравнительно низким содержанием фосфора (0,02—0,03 %), но при этом количество серы достигает 2—3 %.
На Марганецком ГОКе сооружена опытно-промышленная фабрика для извлечения марганца дитионатным процессом из шламов обогащения по технологии, разработанной институтом «Механобрчерм(т» (г. Кривой Рог). Опытно-промышленная фабрика включает следующие объекты:
- корпус химического обогащения, в котором имеется отделение обезвоживания шламов, оборудованное сгустителями диаметром 15 м, центрифугами типа НОГШ-11200, карусельными фильтрами К-50 и другим оборудованием;
- отделение химического обогащения с установкой аппаратов для приготовления, выщелачивания, нейтрализации пульпы (суспензии), осаждения марганцевого концентрата;
- отделение сушки и брикетирования марганцевого концентрата, оборудованное вальцевыми формующимися
сушилками, брикетным прессом; - отделение приготовления раствора полиакриламида;
- отделение сжигания серы, в котором также размещены котел-утилизатор с химводоочисткой и склад хранения серы;
- известегасительная установка для приготовления известкового молока;
- насосная станция оборотного водоснабжения с шестисекционной градацией.
Диоксид серы получают сжиганием серы в реакторе. Обработку суспензии шлам + раствор дитионата кальция сернистым газом ведут в реакторах конструкции ДХТИ, обеспечивающих высокую скорость химических реакций, однако реакторы этой конструкции быстро зарастают вследствие отложения сульфата кальция. Получаемый в опытном порядке концентрат имеет состав 52—56 % Mn; 0,005—0,032 % P; 1,6—3,23 % SiO2; 2,0—3,5 % S.
Авторами работы проведены опыты по использованию дитионатного концентрата в брикетированном виде для выплавки металлического марганца силикотермическим процессом. Брикеты из дитионатного концентрата имели состав: 47—52 % Mn; 2,5—4,0 % SiO2; 1—3 % Fe; 2,4—3,5 % S и 0,012—0,030 % P и соответствовали нормам
ТУ 14-9-299-85. Плавки проводили с заменой части малофосфористого марганцевого шлака брикетами дитионатного концентрата. Подтверждено положение, что применение марганцевых исходных видов сырья с меньшим количеством сопутствующих примесных компонентов (SiO2, Al2O3) повышает извлечение марганца и улучшает весь комплекс технико-экономических показателей.
Так, при замене 50 % малофосфористого шлака дитионатным концентратом производительность печи возросла с 28,2 до 35,84 т/сут, извлечение марганца в сплав повысилось с 62,8 до 65,08 %. При этом на 18 % снизились удельный расход электроэнергии и на 27 % количество отвального шлака. Однако проектная технология 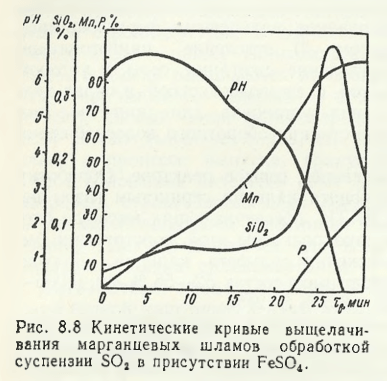 получения дитионатного концентрата в течение десятилетних поисков и освоения фабрики оказалась труднореализуемой. Требуются новые решения, иные подходы, чтобы сооруженная фабрика могла давать товарные марганцевые концентраты. Хотя взаимодействие водных суспензий марганцевых минералов с сернистым газом было изучено в лабораторных условиях достаточно подробно, в промышленных условиях масштабный фактор и используемое оборудование сделали дитионатный процесс в первоначальном варианте технологии трудно осуществимым.
получения дитионатного концентрата в течение десятилетних поисков и освоения фабрики оказалась труднореализуемой. Требуются новые решения, иные подходы, чтобы сооруженная фабрика могла давать товарные марганцевые концентраты. Хотя взаимодействие водных суспензий марганцевых минералов с сернистым газом было изучено в лабораторных условиях достаточно подробно, в промышленных условиях масштабный фактор и используемое оборудование сделали дитионатный процесс в первоначальном варианте технологии трудно осуществимым.
Предложенное Н. М. Гедзем видоизменение дитионатного процесса обеспечивало повышение эффективности, благодаря ведению выщелачивания шламов путем обработки суспензии SO2 в присутствии FeSo4. Из представленных на рис. 8.8 данных следует что FeSO4 как восстановитель обеспечивает ускорение выщелачивания марганца, хотя и в этом варианте, как и в первоначальном, главная трудность (низкая скорость фильтрации кислых выщелоченных пульп) так и не была устранена.
В ФРГ было предложено перевод марганца пиролюзитоной руды в водной суспензии обеспечивать посредством SO2 и воздуха. Причем состав смеси заданного парциального давления SO2 и O2 (ρSO2 : ρO2 = 4—14, предпочтительно 8—12) достигается в результате использования газа SO2 в чистом виде. При этом pH должен быть >4, предпочтительно 4,2. Контроль отношения ρSO2 : ρO2 осуществляется по замерам pH жидкой фазы суспензии. При соблюдении рекомендуемых параметров извлечение марганца достигает 95,3%, а расход серы составляет в среднем 110 % от теоретически необходимого количества.
В Японии предложен способ обработки измельченной марганцевой руды, предусматривающий следующие операции: приготовление водной пульпы из руды, подвергнутой восстановительному обжигу; добавку к пульпе серной кислоты с доведением pH до 2,8—4,0 перемешивание пульпы до pH 4,0—6,0 и фильтрацию пульпы с получением марганецсодержащего раствора и твердого осадка.
Садунишвили А. С. предложен способ извлечения марганца из материалов с высоким содержанием SiO2, включающий обработку исходного материала H2SO4, нейтрализацию полученного продукта аммиаком и отделения раствора образующегося сульфата марганца от твердого остатка. Для интенсификации процесса обработку исходного материала ведут безводной H2SO4 при 250—270 °С в течение 15—20 ч.
В Венгрии разработан способ извлечения марганца из местных бедных карбонатных руд продувкой суспензии дымовыми газами ТЭЦ, содержащими до 0,2 % SO2. Концентрацию марганца в растворе доводят до 60 г/л. Из раствора марганец осаждают в виде концентрата (62—64 % Mn, 0,01 % Р, 0,05 % S, 3—4 % СаО, 0,5 K2O, 1—
2 Na2O). В 1970 г. была введена в действие опытная установка для получения этим способом марганцевого концентрата, а также создан проект обогатительной фабрики для переработки 280 тыс. т марганцевой руды в год. Невыгодную для переработки металлургическими процессами марганцевую руду (21 % Mn, 16 % Fe, 0,6 % S, 3,32 % P, 0,35 % Zn, 20,45 % Al2O3, 6,1 % MgO) размалывают по 4. Составленную смесь обжигают при 550 °С в течение 30—120 мин в окислительной печной атмосфере. Спек выщелачивают водой при отношении Ж : Т = 4 : 1 или 6: 1. Р1ри выщелачивании через пульпу пропускают SO2 в раствор в виде MnSO4. Переработку раствора MnSO4 можно вести известными методами. Высокое извлечение марганца в раствор (95 %) объясняется активной ролью SO2 как на пиро-, так и гидрометаллургических стадиях процесса. Пурцеладзе X. Г. разработал способ извлечения марганца из бедных руд с использованием на стадии
обжига руды элементарной серы как восстановителя пиролюзита, 2MnO2 + S = 2MnO + SO2, а SO2 на стадии выщелачивания руды.
Азотнокислые процессы
Выщелачивание марганца из низкокачественного марганецсодержащего сырья обычно относят к круговым
процессам, поскольку используемая HNO3 в голове технологической схемы может быть регенерирована и возвращена в схему. Особенностью химизма азотнокислотного процесса является восстановительный
обжиг исходного сырья для перевода MnO2 в MnO. При выщелачивании обожженного продукта азотной кислотой в раствор переходит марганец, а оксиды Fe3O4, SiO2, и Al2O3 не растворяются. В круговом азотнокислотном процессе Носсена, описанного А. Салли, фосфорсодержащие вещества в раствор также не переводят. Раствор, содержащий нитраты марганца и в небольших количествах нитраты натрия, калия и магния, фильтруют и выпаривают, после чего переводят в агрегат из коррозионностойкой стали для разложения. Процесс ведут при 200 °С. Выпаривание, сопровождающееся разложением раствора нитрата марганца, ведут до получения диоксида марганца. Образующиеся при выпаривании раствора пары HNO3 конденсируются и при концентрации ~50 % возвращаются на стадию выщелачивания.
Пурцеладзе X. Г., чей большой вклад в разработку и исследования химических процессов извлечения марганца из бедного марганецсодержащего сырья известен, в одной из работ обобщил данные химического обогащения бедных руд и шламов с использованием HNO3, ее регенерации и возвращением в процесс. Основными стадиями этой технологии являются: дробление и помол руды, восстановительный обжиг, выщелачивание, осаждение примесей, фильтрация суспензии, промывка шлама водой, выпарка раствора нитрата марганца, прокаливание для получения конечного товарного марганцевого концентрата и возвращения в голову процесса пара NO2, абсорбированного водой (т. е. HNO3).
Процесс восстановительного обжига сырья, содержащего MnO2, описывается реакцией
MnO2 + СО + H2 → MnO + CO2 + H2O.
При этом происходит также диссоциация карбонатов CaCO3 и MnCO3.
Для восстановления MnO2 до MnO предложено руду обрабатывать смесью газов, в которой соотношение воздуха и CH4 находится в пределах от 2 : 1 до 4 : 1 (предпочтительно от 2,4 : 1 до 3,5 : 1) при 537—1093 °С (предпочтительно 673—712 °С) с добавлением в эту смесь некоторого количества СО и H4 для каталитического действия. Взаимодействие MnO с HNO3 сопровождается образованием нитрата марганца:
MnO + 2HNO3 → Mn (NO3)2 + H2O.
Наряду с указанной основной реакцией на стадии выщелачивания восстановленной руды протекают попутные, приводящие к переходу в раствор Mg (NO3)2, Al (NO3)3, Ca (NO3)2. Фосфат кальция растворяется по реакции
Ca3 (PO4)2 + 6HNO3 → Ca (NO3)2 + 2H3PO4.
Осаждение примесей ведут при pH 4—5, что сопровождается выпадением из раствора Fe (ОН)3, Al (ОН)3, а взаимодействие Fe (ОН)3 с H3PO4 сопровождается образованием FePO4 и H2O. Фильтрация получаемой суспензии позволяет получить раствор нитрата марганца Mn (NO3)2 с некоторым количеством примесей нитратов кальция и магния.
В случае переработки раствора нитрата марганца для получения марганцевого концентрата раствор выпаривают и прокаливают при 700—800 °С. В ходе концентрирования раствора, а затем прокаливания твердого осадка сложные соединения разлагаются по общей схеме
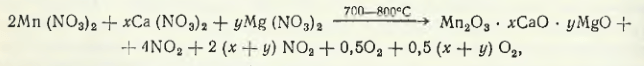
где x + y всегда меньше 1.
В зависимости от состава руды, по данным X. Г. Пурцеладзе, сумма x + y может колебаться от 0,05 до 0,8. Из оксидного марганецсодержащего сырья получены концентраты с 60—70 % Mn и адсорбируются водой по схеме 2NO2 + H2O + O2 → 2HNO3 и в виде кислоты направляются в голову процесса на выщелачивание предварительно восстановленного марганецсодержащего сырья.
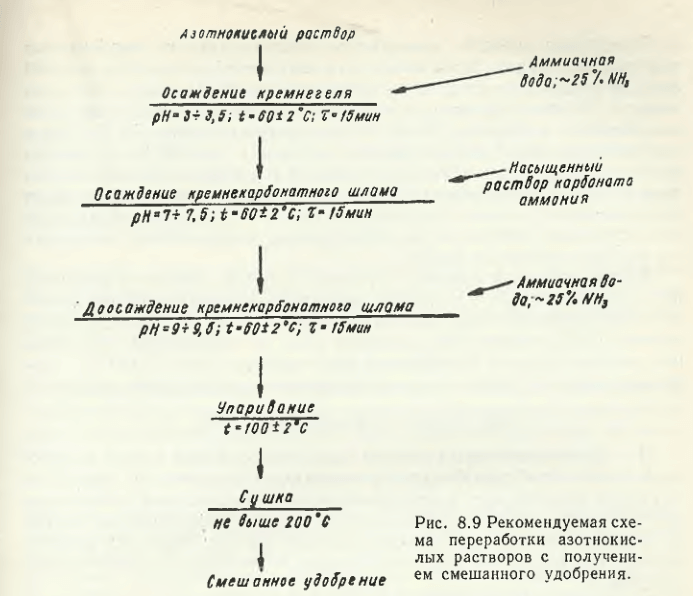
На основе нитрата марганца X. Г. Пурцеладзе разработаны технологии получения активного диоксида марганца, перманганата калия, карбоната, нитрата, сульфата и хлорида марганца реактивных квалификаций. В одной из предложенных им схем предусматривается получение смешанного удобрения (рис. 8.9).
Активный диоксид марганца автор работы рекомендует получать путем озонирования растворов, содержащих Mn (NO3)2, по реакции
Mn (NO3)2 + H2O + O3 → MnO2 + 2HNO3 + O2.
Процесс получения перманганата калия схематически описывается следующими реакциями:
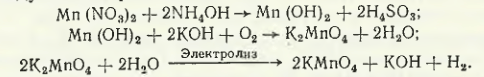
Более совершенным вариантом является способ получения KMnO4, когда манганатный раствор окисляют озоном по реакции
2K2MnO4 + H2O + O3 → 2KMnO4 + 2KOH + O2,
что исключает применение электролиза.
Предложен способ кислотного выщелачивания карбонатных марганцевых руд с применением для этих целей концентрированной азотной кислоты (допускается использование H2SO4 или смеси этих кислот). Причем значение pH суспензии после выщелачивания руды должно быть в пределах 4—5, а температура не ниже 70 °С. Затем разбавлением водой концентрацию марганца в жидкой фазе доводят до 70—100 г/л. После центрифугирования к раствору добавляют раствор NH4OH (или щелочи). Осадок гидрооксида марганца отделяют фильтрованием, а затем прокаливают при 700 °С. Попутно образуются искусственные удобрения со значительным содержанием азотистых соединений кальция и калия.
Хлоркальциевый процесс
Сущность процесса состоит в автоклавной обработке сырой или предварительно восстановленной марганцевой руды раствором хлорида кальция CaCl2. По Н. В. Толстогузову, раствор CaCl2 должен быть насыщен CO2, а температура автоклавного выщелачивания обожженной руды должна быть ~160 °С. Химизм процесса в общем виде выщелачивания описывается реакцией
MnO + CaCl2 + CO2 → MnCl2 + CaCO3.
Из отфильтрованного раствора марганец осаждают в виде гидроксида путем обработки фильтрата известью. Прокаленный гидроксид марганца представляет высококачественный марганцевый концентрат (до 68 % Mn) с низким содержанием фосфора. Приведенное лишь в общем виде характеризует хлоркальциевый процесс, хотя для практической его реализации требуются новые, более обстоятельные исследования.
Толстогузов Н. В. проанализировал растворимость солей в трехкомпонентной системе CaCl2 — MnCl2 — H2O на основании данных об активности компонентов в бинарных системах CaCl2 — H2O и MnCl2 — H2O. В результате ряда преобразований Н. В. Толстогузов, используя уравнение Гиббса — Дюгема, получил выражение
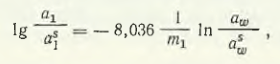
где a1, a1s — соответственно активности соли в бинарном растворе и насыщенном трехкомпонентном растворе; m1 — концентрация MnCl2 в бинарном растворе MnCl2 — H2O; aws — активность воды в точке насыщенного бинарного раствора; aw — активность воды.
Исследования показали, что, например, при 25 °С и активности воды 0,46 концентрации MnCl2 (m1) и CaCl2 (m2) соответственно равны 7,77 и 5,43 моль/100 г H2O. В трехкомпонентной системе CaCl2 — MgCl2 — H2O при этой же активности H2O aw расчетные концентрации MnCl2(m1) и CaCl2(m2) при 25 °С составили: m1 = 1,34 моль
MnCl2/1000 г H2O; m2 = 4,39 моль CaCl2/1000 г Н2O. С повышением температуры до 200 °С растворимость MnCl2 повысилась до m1 = 1,63 моль/1000 г H2O, тогда как CaCl2 до m = 7,59 моль/1000 г H2O. П. В. Толстогузовым экспериментально изучено влияние параметров выщелачивания на извлечение марганца, в частности, массовой концентрации CaCl2 (х = 47…52 %), температуры (200—220 °С), продолжительности выщелачивания (τ = 2…4 ч) и степени измельчения (s = 0,125…0,220 мм). Методом математического планирования показано, что на извлечение марганца из богатой кальцийродохрозитовой руды (23,5 % Mn) yp наибольшее влияние оказывает концентрация CaCl2 (х):
yр = 70,600 — 5,900x.
Аналогично влияет повышение концентрации CaCl2 на извлечение марганца из родохрозитовой руды. Вместе с тем при выщелачивании манганокальцитовой руды наиболее сильное влияние оказывает степень измельчения s:
ум = 59,52 . . . 3,40.
Качество получаемого хлоркальциевым способом марганцевого концентрата при прочих равных условиях определяется содержанием примесей в извести, используемой для осаждения марганца по реакции
MnCl2 + Ca (ОН)2 = Mn (ОН)2 + CaCl2,
так как удельный расход Ca (ОН)2 достаточно велик. При использовании практически химически чистой CaO (99,9 %) концентрат содержал 62,64 % Mn (или 89,71 % Mn3O4), 0,0009 % P и 0,002 % S. В случае приготовления известкового молока с использованием извести 95,6 % CaO, 0,036 % P и 0,05 % S содержание примесей в концентрате повысилось до 0,22 % P и 0,034 % S (при 61,15 % Mn или 84, 78 % Mn3O4).
Для обеспечения низкого содержания СаCl2(в опытах составляло 5—8 %) концентраты необходимо подвергать многократной промывке водой. Толстогузов Н. В., А. И. Селиванов, И. Е. Пронухин заключили, что CaCl2 в количествах 3—8 % способствует окомкованию концентрата нагреванием до 700—800 °С. Обращено внимание на положительное влияние CaCl2 как разжижителя кислых и основных металлургических шлаков. Вопросы хлоридной металлургии марганца обстоятельно проанализированы в работах Ю. М. Картвелишвили (Грузия).