Общие сведения о скандии
Элемент с атомным номером 21 “экабор” и его свойства предсказал в 1871 г. Д.И.Менделеев. Открыл элемент шведский химик Нильсон в 1879 г., работая над извлечением редкоземельного элемента иттербия из минерала гадо- линита. Металлический скандий 94-98 %-ной чистоты получен в 1937 г. Фишером электролизом расплавленного хлорида скандия.
Свойства скандия
Скандий – элемент IIIА подгруппы Периодической системы химических элементов. В природе известен один стабильный изотоп 45Sc; известно 12 искусственных радиоактивных изотопов.
Ниже приведены некоторые физические свойства скандия:
Атомная масса …………44,9559
Плотность, г/см3 …….2,989
Тип и параметры решетки, нм: гексагональная, α= 0,33085, с = 0,5268; ОЦК (выше 1337 °С)
Температура:
- плавления…….1541 °С
- кипения………..2836 °С
Удельная теплоемкость, Дж/(моль • К), при t, °С:
- 25……..25,52
- 1500……..39,80
Теплопопроводность, В/(см • К )……..0,157
Твердость по Бринеллю, МПа…….390
Удельное электросопротивление поликристаллического образца р250c, мкОм • см ….. 41 – 51
Компактный скандий – серебристо-белый металл. Непосредственно реагирует с кислородом, галогенами, серой, углеродом. На воздухе образующаяся на поверхности металла пленка предотвращает дальнейшее окисление. С азотом реагирует выше 500 °С с образованием нитрида ScN. При нагревании вытесняет водород из воды, легко растворяется в минеральных кислотах, за исключением хромовой и плавиковой кислот, медленно реагирует с концентрированным раствором гидроксида натрия. Радиус иона Sc3+ (0,083 нм по Н.В.Белову и Г.В.Бокию) меньше, чем радиус иона Y3+ (0,097 нм), и трехзарядных ионов РЗЭ (0,088 – 0,103 нм). Поэтому в соединениях скандия выражено стремление к гидролизу сильнее, чем в аналогичных соединениях РЗЭ. Скандий склонен к образованию двойных и комплексных соединений с анионами и нейтральными лигандами в большей мере, чем РЗЭ.
С металлами I, II, VII, VIII побочных подгрупп и II, III, IV, V главных подгрупп Периодической системы элементов скандий образует интерметаллические соединения типа ScМе, Sc2Ме, ScМе2, ScМе3 и другие.
Элементы III, IV, V и VI побочных подгрупп образуют со скандием эвтектики или области несмешиваемости в жидком состоянии, проявляется растворимость в твердом состоянии.
Свойства соединений скандия
Скандий образует соединения, отвечающие степени окисления элемента +3. Другие степени окисления нехарактерны для скандия.
Оксид и гидроксид скандия. Оксид Sc2O3 – белое вещество, образующееся при окислении скандия кислородом, термическом разложении гидроксида, карбоната, оксалата, сульфата, нитрата скандия. tпл = 2480 °С, плотность 3,86 г/см3. В воде малорастворим. Хорошо растворяется в концентрированных минеральных кислотах.
Гидроксид скандия Sc(ОН)3 – аморфное соединение. Осаждается действием на растворы солей скандия растворами аммиака или щелочей; pH начала выделения 4,9. Растворим и растворах щелочей, карбонатов аммония, щелочных металлов; растворимость резко снижается в присутствии малорастворимых гидроксидов железа, марганца и др.
Карбонат скандия. Для скандия характерно образование основных карбонатов [Sc(OН)m]2(СO3)3-m • 3H2O, растворимых в растворах (NH4)2CO3 и Na2CO3 лучше, чем аналогичные соединения РЗЭ.
Нитрат скандия Sc(NO3)3 • 4H2O – хорошо растворимая соль; растворимость в воде: 61,27% (при 15 °С), 67,60% (при 50 °С).
Сульфат скандия Sc2(SO4)3 образует гидраты с 2; 4; 5 и 6 молекулами воды. Растворимость в воде 28,53% (при 25 °C). С сульфатами щелочных металлов образует соединения Me[Sc(SO4)2], или К3(Sc(SO4)3] в 20 раз менее растворим в растворе К2SO4, чем аналогичные соединения элементов иттриевой подгруппы РЗЭ.
Фосфат скандия ScPO4 • 2H2O – малорастворим, получается действием на водный раствор солей скандия фосфорной кислоты.
Оксалат скандия Sc2(C2O4)3 • nH2O(n ≈ 3; 4; 5; 6; 18) образуется при действии щавелевой кислоты на нейтральные или слабокислые растворы солей скандия. Малорастворим, ПРSc2(C2O4)3 = 10-27.
Йодат скандия Sc(IO3)3 • 1,5H2O – хорошо растворим в отличие от аналогичных соединений тория и циркония.
Фторид скандия ScF3 – белое кристаллическое вещество,t = 1552 °С, tкип = 1607 °С. Малорастворим, ПРScF = 3 • 10-20. При обработке концентрированной H2SO4 превращается в сульфат, при нагревании в растворе NaOH – в гидроксид. Растворим в HF, растворах фторидов щелочных металлов и аммония; в растворе образуются комплексы [ScF4]–, [ScF6]3-.
Хлорид скандия ScCl3 – белое кристаллическое вещество, гигроскопичен, tпл = 968 °С, tкип = 975 °С. Температурная зависимость давления пара (МПа): lgP = -14200/T + 10,49 (1066 – 1229 К).
Кристаллогидрат ScCl3 •6H2O при нагревании на воздухе превращается сначала в оксохлорид ScOCl, плохо растворимый в воде, кислотах и щелочах, затем – в Sc2O3.
Карбид скандия ScC изучен больше, чем другие карбиды скандия. Получается синтезом из элементарных веществ или восстановлением Sc2O3 углем. Температура плавления 1800 °С, микротвердость 26,7 ГПа.
Области применения скандия
Скандий и его соединения в настоящее время применяют в производстве легких сплавов, электронной технике, светотехнике, производстве специальной керамики. Возможности применения скандия ограничены высокой ценой. В 1988 г. оксид скандия (1 г) стоил 2,8 долл., дистиллированный металл (чистота 99,99%) – 15 долл. Высокая цена связана с малыми объемами производства (около 100 кг в год в пересчете на металл). Основные производители скандиевой продукции – КНР, Франция.
Легкие сплавы
Скандий представляет интерес как конструкционный материал для ракето- и самолетостроения, астронавтики, поскольку, обладая значительно более высокой температурой плавления, чем алюминий, имеет ту же плотность. Особый интерес представляют сплавы Al — Sc, Mg – Sc, Mg – Sc – Li, Mg – Y – Sc. Так как добавка десятых долей процента скандия к алюминию и его сплавам обусловливает повышение прочностных, в определенных случаях пластических свойств, рост сопротивления против коррозионного растрескивания, улучшение свариваемости деформированных полуфабрикатов. При кристаллизации расплава в процессе образования слитков большая часть скандия входит в пересыщенный раствор, а оставшаяся часть выделяется в виде частиц Al3Sc (рис. 89), которые обусловливают измельчение литого зерна.
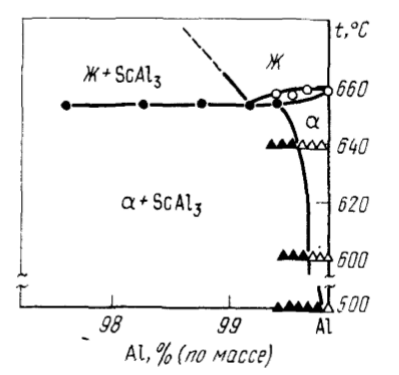
Легирование 0,4% скандия сплавов Al – Mg (2 – 8,5 Mg) увеличивает временное сопротивление на 20 – 35 %, а предел текучести на 60 – 80 %. При этом относительное удлинение остается достаточно высоким (15 – 20%).
Электронная техника
Важная область применения оксида скандия – производство ферритов для ЭВМ с индукцией 0,08 – 0,1 Тл, что в 3 раза меньше, чем у ферритов из оксидов железа, магния, марганца. Такие ферриты меньше перегреваются при перемагничивании, что увеличивает быстродействие магнитной памяти ЭВМ.
Светотехника
Мателлогалогенидные (иодидные) ртутные лампы с добавками скандия используют для освещения промышленных зданий и спортивных сооружений.
Производство керамики
Разработаны различные виды керамики на основе ZrO2 и HfO2 с добавками Sc2O3, успешно работающие при высоких температурах.
Другие области применения
Гидрид скандия используют в ядерной технике как высокотемпературный замедлитель нейтронов. Борид скандия ScB2 предложено использовать как компонент легких жаропрочных сплавов, а также в материалах катодов электронных приборов. Оксид скандия – компонент германатных оптических стекол, люминофоров.
Сырьевые источники скандия
Скандий – типичный рассеянный литофильный элемент. Содержание его в земной коре 10-3% (по массе). Собственных месторождений не образует.
Собственные минералы скандия – тортвейтит Sc2[Si2O7] и стереттит ScPO4 • 2H2O – большая редкость и промышленного значения не имеют. Более распространены минералы, в которых скандий присустсвует в виде изоморфной примеси в количестве 0,005 – 0,3% Sc2O3. Скандийсодержащие минералы (оксиды, карбонаты, силикаты, фосфаты, вольфраматы) содержат ионы, характеризующиеся близким к Sc3+ (0,083 нм) радиусом иона, нм: Fe2+ 0,080, РЗЭ 0,102 – 0,080, Mg2+ 0,074, Са2+ 0,104, Mn2+ 0,091, Zr4+ 0,082, Th4+ 0,095, и U4+ 0,089. Изоморфизм обусловлен также близостью других кристаллохимических констант скандия и перечисленных элементов.
Проблема промышленного получения скандия может быть решена при использовании рассеянного скандия, извлекаемого попутно из руд цветных и редких металлов. При концентрировании скандия в отходах производства (растворах, шламах, шлаках и пр.) создаются условия для извлечения без нарушения основной технологии.
Титановое сырье
В титановом сырье содержится Sc2O3 (до 0,1 % в ильмените, до 0,3 % в сфене). При обогащении ильменитовых концентратов путем восстановительной электроплавки скандий переходит в титановый шлак.
Цирконийсодержащие руды
Цирконы и другие минералы циркония содержат 0,001 – 0,08 % Sc2O3. При переработке цирконового концентрата спеканием известью и хлоридом кальция скандий концентрируется в основном в маточниках после выделения основного сульфата циркония.
Руды вольфрама
Содержание Sc2O3 в вольфрамитах 0,005 – 1,0 %. При гидрометаллургической переработке, включающей спекание концентрата Na2CO3 и последующее выщелачивание, скандий остается в кеке от выщелачивания, и его содержание повышается в 2 — 3 раза по сравнению с содержанием в вольфрамите.
Руды урана
Руды урана содержат 10-3 – 10-4% Sc2O3. При вскрытии урановых руд серной или азотной кислотами скандий переходит вместе с ураном в раствор. При вскрытии руд растворами Na2CO3 скандий в основном концентрируется в кеках от выщелачивания.
Руды алюминия
Бокситы содержат 0,001 – 0,01 % Sc2O3. Ввиду больших масштабов переработки бокситы могут стать важным источником скандия. При переработке бокситов по способу Байера и способу спекания скандий преимущественно остается в красном шламе.
Другие источники скандия
Другие источники скандия – некоторые жедезные руды (содержание 0,001 – 0,005 % Sc2O3), руды олова (0,02 – 0,22 % Sc2O3), концентраты берилла (0,1 – 0,2 % Sc2O3), золы некоторых углей (0,01 % Sc2O3), фосфориты.
Переработка скандийсодержащего сырья
Содержание скандия в продуктах переработки минерального сырья составляет сотые – десятые доли процента. Поэтому из исходных продуктов вначале получают концентраты, которые затем перерабатывают на соединения скандия.
Для извлечения скандия из продуктов в раствор применяют выщелачивание кислотами (например, соляной кислотой), разложение хлорированием, серной кислотой или гидроксидом натрия с последующим водным или кислотным выщелачиванием.
Для выделения скандия из растворов используют следующие основные способы:
- осаждение в составе малорастворимых соединений,
- экстракция органическими растворителями,
- ионообменные способы.
Методы осаждения
Осаждение гидроксида
Осаждение гидроксида используют для отделения от щелочных и щелочно-земельных металлов:
ScCl3 + 3NH3 • H2O = Sc(ОН)3 + 3N4HCl (12.1)
Из данных табл.11 следует, что возможно, используя разницу pH осаждения гидроксидов, в некоторой степени очистить скандий от Zr, Ti, Th и Ce (+4), так как они осаждаются при более низких pH, чем гидроксид скандия, и от ряда РЗЭ и Fe (+2), осаждающихся при более высоких значениях pH. Метод не дает возможность отделить Fe (+3), в присутствии которого Sc(ОН)3 осаждается при более низком значении pH, и от алюминия, имеющего близкое значение pH осаждения. Метод прост, недостаток его – плохая фильтруемость осадков.

Осаждение оксалата
В результате осаждения оксалата скандия
2ScCl3 + 3H2C3O4 + 6H2O = Sc2(C2O4)3 • 6H2O + 6HCl (12.2)
возможно отделение скандия от алюминия и железа. При избытке щавелевой кислоты осаждение неполное вследствие образования комплексного аниона [Sc(C2O4)3]3-. Условия осаждения: pH = 2÷3, температура 90 °С, продолжительность 4 ч.
При выделении оксалата скандия, особенно из бедных растворов, более полному осаждению способствует присутствие кальция, играющего роль носителя.
Для отделения от РЗЭ используют разницу в устойчивости комплексных соединений, образуемых оксалатами скандия и РЗЭ и ЭДТА.
При кипячении раствора, содержащего эти комплексные соединения, менее прочные соединения РЗЭ разлагаются, и РЗЭ могут быть выделены из раствора в составе оксалатов. После отделения раствора, вводя в него твердую щавелевую кислоту, скандий выделяют в осадок.
Осаждение карбоната
Карбонат скандия растворяется в отличие от соединений РЗЭ, Fe, Mn, Ca в избытке раствора Na2CO3 или (NH4)2CO3 с образованием комплексных соединений, что рекомендовано использовать для очистки от РЗЭ, Fe, Mn, Ca:
Sc3+ + 4Na2CO3 = Na5[Sc(CO3)4] + 3Na+; (12.3)
Sc3+ + 2(NH4)2CO3 = NH4[Sc(CO3)2] + 2NH4+. (12.4)
Карбонатный комплекс при кипячении разрушается. В осадок выделяется плохо растворимый карбонат скандия переменного состава.
Недостаток карбонатной обработки – необходимость применения большого объема растворов соды или карбоната аммония в связи с умеренной растворимостью в них соединений скандия и плохая фильтруемость осадков.
Осаждение фторида
ScF3 – малорастворим, но растворяется (в отличие от фторидов РЗЭ и тория) в растворе NH4F с образованием фтороскандата:
ScF3 + 3NH4F = (NH4)3ScF6] (12.5)
Для выделения фторида скандия из бедных растворов применяют фториды и кремнефториды натрия и калия, плавиковую кислоту, кремнефтористоводородную кислоту; осадитель берут с избытком.
Недостаток метода – трудность перевода фторида скандия в растворимое состояние. Для этого необходима обработка концентрированной серной кислотой при 180 – 250 °С или 20 – 30 %-ным раствором NaOH при 60 – 80 °С в течение 2 – 3 ч.
Ионный обмен
Метод применяют:
- для выделения соединения скандия из разбавленного раствора;
- для очистки растворов соединений скандия от примесей.
С целью повышения эффективности при очистке скандия от наиболее трудно отделяемых примесей (РЗЭ, Y, Th) применяют сочетание ионообменного разделения на катионитах с комплексообразованием (при десорбции). Хорошие десорбенты – лимонная кислота и этилендиаминтетрауксусная кислота. Устойчивость комплексных соединений повышается в ряду La
Процесс включает:
1) пропускание раствора с разделяемой смесью через колонку со смолой в аммонийной или водородной форме (стадия сорбции):
Sc3+ + 3NH4R ⇔ ScR3 + 3NH4+; (12.6)
2) десорбцию ионов раствором лимонной кислоты (или ЭДТА):
ScR3 + 2H3C6H5O7 ⇔ Н3[Sc(C6H5O7)2] + 3HR (12.7)
Экстракция
Один из наиболее разработанных способов – экстракция роданидного комплекса H[Sc(CNS)4] диэтиловым эфиром из хлоридных или нитратных растворов. Коэффициенты распределения скандия и ряда сопуствующих элементов сильно различаются (pH = 3,5):

Перед экстракцией Fe(+3) восстанавливают до Fe(+2). Скандий реэкстрагируют, многократно обрабатывая экстракт водой. Недостаток способа – огнеопасность экстрагента, большой расход роданида аммония.
Другие экстрагенты, применяемые в технологии скандия: ТБФ, диалкильные эфиры алкилфосфорной кислоты (ДААФ), Д2ЭГФК и др. Экстракцию скандия ТБФ и ДААФ проводят в сильнокислых средах в присутствии высаливателей (хлориды или нитраты кальция и магния). Экстракция скандия ТБФ из хлоридных растворов протекает с образованием сольватов ScCl3 • xТБФ (x меняется от 2 до 3 в зависимости от условий кислотности и наличия высаливателей). Коэффициент распределения скандия при экстракции ТБФ из 6 н.HCl составляет 3,2, иттрия – 0,001 (т.е. коэффициент разделения равен 3200). Реэкстрагируют скандий разбавленной HCl.
Алкилфосфорные кислоты имеют меньшую селективность, чем ТБФ, и вместе со скандием экстрагируют цирконий, торий, титан, железо, уран и др. Поэтому такие экстрагенты применяют главным образом для выделения скандия из бедных (кислых или нейтральных) растворов с целью концентрирования. Из нейтрального раствора экстракция протекает по катионообменному механизму за счет образования соли скандия с органической кислотой, растворимой в этой кислоте:
nSc3+ + 3НnХ ⇔ ScnX3 + 3nH+ (12.8)
где НnХ – алкилфосфорная кислота. Недостаток способа – реэкстрагировать скандий можно лишь плавиковой кислотой или раствором щелочи, в результате чего получается трудно фильтрующийся осадок ScF3 или Sc(OH)3.
Примеры переработки скандийсодержащего сырья
Переработка тортвейтита
Существуют следующие способы:
- кислотные (вскрытие HCl, H2SO4, NH4HF2, плавиковой кислотой);
- щелочные (сплавление с NaOH, спекание с Na2CO3);
- карбидный;
- хлорирование.
Кислотное вскрытие требует многократного повторения процесса. При высокотемпературном вскрытии щелочью или содой
Sc2O3 • 2SiO2 + 2Na2CO3 = Sc2O3 + 2Na2SiO3 + 2CO2 (12.9)
скандий остается после водного выщелачивания спека в остатке. Остаток растворяют в HCl; аммиаком осаждают гидроксид скандия. Растворяя гидроксид в 6 – 8 н. HCl и экстрагируя эфиром, отделяют железо. Остальные примеси отделяют, экстрагируя эфиром роданид скандия. После отгонки эфира скандий осаждают в виде двойного тартрата с аммонием; извлечение равно 96 %.
Карбидный способ заключается в образовании карбидов в результате нагревания при 1800 – 2100 °С смеси минерала и древесного угля (соотношение 1:1,2). При обработке карбидов соляной кислотой в раствор переходят Sc, РЗЭ, Al, Fe, Ti, Zr. Карбид кремния соляная кислота почти не разлагает. Из раствора осаждают оксалат скандия, после повторного переосаждения получают богатый скандиевый концентрат, содержащий 10 % оксидов РЗЭ. Дальшейшую очистку ведут дробным осаждением гидроксидов и ионным обменом.
При переработке хлорированием тортвейтит в смеси с углем нагревают в токе хлора при 900 – 1000 °С. Различие температур кипения и конденсации хлоридов элементов, составляющих минерал, дает возможность их разделить в процессе конденсации. Хлориды Si, Zr, Al, Fe, Ti конденсируются ниже 400 °C; ScCl3 – при 600 – 900 °C; выход равен 87,5 %. В зоне хлорирования в плаве остаются хлориды РЗЭ.
Переработка уран-ториевых руд
По технологической схеме уранового завода в Солт-Лейк-Сити (США, штат Юта) получают растворы, в которых наряду с ураном содержится 0,001 г/л Sc2O3. При экстракции урана 0,1 М раствором додецилфосфорной кислоты в керосине скандий переходит в экстракт вместе с ураном, торием, титаном. Уран реэкстрагируют 10 н. HCl; скандий остается в органической фазе вместе с торием и титаном и концентрируется до 0,1 г/л Sc2O3. Из экстрагента действием плавиковой кислоты осаждают фториды скандия и тория. Скандиево-ториевый кек, содержащий 10 % Sc2O3 и 20 % ThO2, перерабатывают с целью извлечения скандия. Фторидный кек вскрывают 15 %-ным раствором ИаОН при 75 – 90 °С в течение 4 ч. Образовавшиеся гидроксиды обрабатывают соляной кислотой при 100 °С, устанавливая pH = 4; этим достигается очистка от Zr, Th, Ti, Si частично от Fe (III), которые остаются в осадке. Из раствора щавелевой кислотой осаждают скандий. Оксалат скандия отфильтровывают, сушат, прокаливают.
Для получения Sc2O3 чистотой более 99,5 % дальнейшую очистку от примесей ведут экстракционным методом после растворения Sc2O3 в соляной кислоте. Экстрагируют диэтиловым эфиром в присутствии NH4CNS. Из органической фазы скандий реэкстрагируют водой и аммиаком осаждают в составе гидроксида; прокаливанием при 700 °С гидроксид переводят в Sc2O3.
Для извлечения скандия вместе с ураном из сернокислых растворов после выщелачивания урановой руды (завод Порт-Пири, Австралия) используют Д2ЭГФК. После реэкстракции урана скандий накапливается в органической фазе. После содовой обработки экстракта получают кек, содержащий, %: Sc 0,14, Th 0,14, Тi 0,3, и U3O8 24, Fe 38. Технологическая схема, приведенная на рис. 90, позволяет извлечь из кека 90 % Sc и получить оксид скандия чистотой 99,6 %.
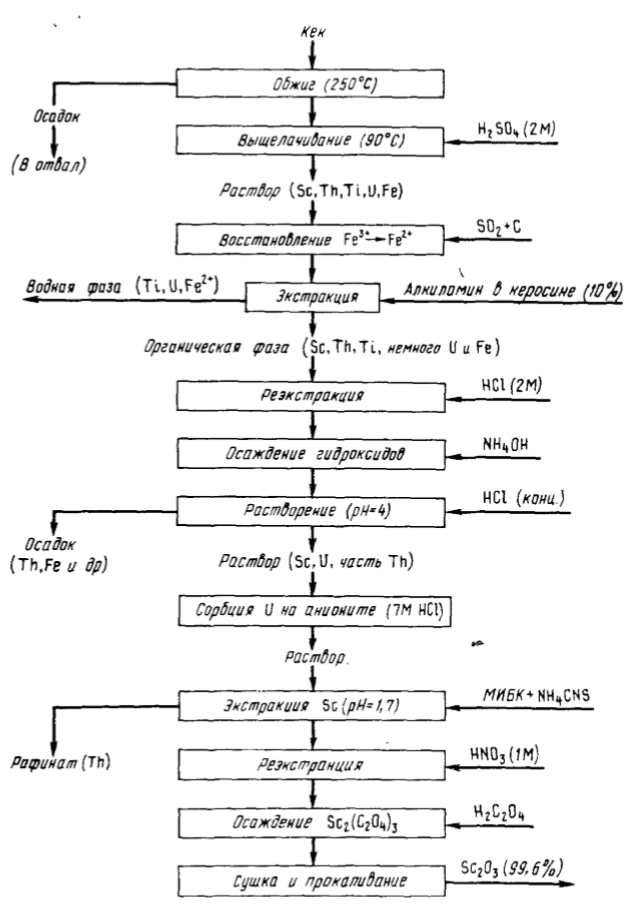
По этой схеме кек вскрывают серной кислотой, скандий концентрируют, экстрагируя 10 %-ным раствором первичного алкиламина. При этом в экстаракт переходит 97 % Sc, 97 % Th, 55 % Ti 7 % U, 2 % Fe, предварительно Fe (III) восстанавливают SO2 в присутствии активированного угля до Fe (II). После реэкстракции 2 н. HCl соотношение скандия и примесей изменяется от 1:410 до 1:10. Дальнейшие операции предусматривают доочистку скандия. От урана скандий отделяют сорбцией на анионите, от тория – экстракцией роданидного комплекса скандия метилизобутилкетоном. Окончательно скандий выделяют в составе оксалата, который при прокаливании переходит в оксид.
Переработка титаномагнетитовых концентратов
В титановом шлаке, получаемом в результате восстановительной плавки титаномагнетитов, содержится 0,005 – 0,009 % скандия. При хлорировании шлаков большая часть скандия в составе хлорида концентрируется в отработанном расплаве титановых хлораторов (до 0,01 – 0,03 % Sc2O3). Расплав обрабатывают раствором HCl (20 – 40 г/л), выщелачивая скандий. Раствор отфильтровывают, корректируют содержание Fe(III), скандий экстрагируют 70%-ным раствором ТБФ в керосине. Установлено, что FeCl3 способствует экстракции скандия ТБФ, однако повышение содержания FeCl3 в растворе приводит к загрязнению экстрагента. Кроме того, FeCl3 образует с ТБФ соединение, имеющее ограниченную растворимость в ТБФ, что приводит к загустеванию органической фазы, образованию эмульсии. Оптимальная концентрация FeCl3 в исходном растворе 7-12 г/л. Корректировка содержания FeCl3 перед экстракцией заключается в восстановлении Fe3+:
2FeCl3 + Mg = 2FeCl2 + MgCl2 (12.10)
Экстракт, обогащенный скандием, отмывают от примесей соляной кислотой (220 – 240 г/л), скандий реэкстра ги- руют с помощью 7%-ного раствора HCl. Из реэкстракта щавелевой кислотой осаждают оксалаты скандия и других элементов, пульпу фильтруют, осадок сушат и прокаливают при 700 °С, получая технический оксид скандия, содержащий 40 – 60% Sc2O3.
Технический оксид скандия растворяют в соляной кислоте, экстрагируют скандий с помощью ТБФ, из реэкстракта после многократных переосаждений йодатов [очистка от Th (IV) и Zr (IV)], гидроксидов и оксалатов получают товарный оксид скандия, содержащий более 99,9% Sc2O3.
Переработка отходов вольфрамового и оловянного производства
Отвальные кеки гидрометаллургической переработки вольфрамитовых концентратов состоят в основном из оксидов железа (25 – 35 %) и марганца (25 – 35 %), содержат Nb, Ta, Th, U, Sn РЗЭ и 0,15 – 0,50 % Sc2O3. Для выделения скандия известны методы хлорирования, методы вскрытия соляной или серной кислотой.
Более высокое извлечение скандия достигнуто в результате вскрытия кеков 98 %-ной серной кислотой при 220,°С (Т:Ж = 1:1,4) (рис.91). При водном выщелачивании в раствор вместе со Sc (0,2 – 0,3 г/л) переходят большая часть железа (15 – 25 г/л), марганца (15 – 20 г/л), Zr, Ti, Th, РЗЭ, Al и другие примеси. Железо и алюминий отделяют карбонатным методом, основанным на способности скандия образовывать комплексные карбонаты с содой и карбонатом аммония, растворимые в избытке соответствующего карбоната.
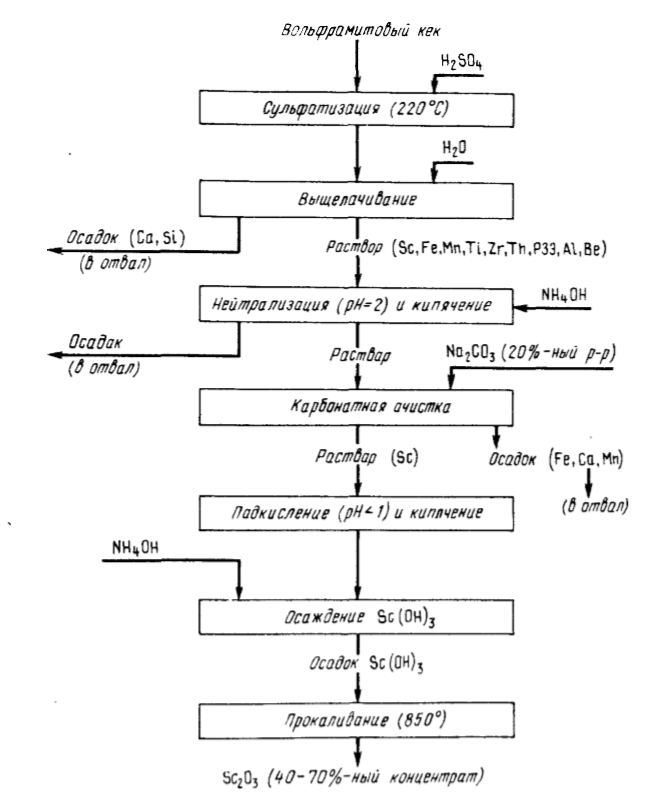
Из раствора после подкисления HCl до pH = 1 и кипячения осаждают Sc(OH)3, прибавляя концентрированный раствор аммиака. Прокаливая гидроксид, получают 40 – 70 %-ный Sc2O3. Дальнейшую очистку от примеси Ti, Zr, Th, РЗЭ проводят экстракционными методами с применением различных экстрагентов. Извлечение скандия составляет 80 – 88 %, чистота Sc2O3 99,99 %.
Переработка шлаков ферровольфрамового и оловянного производства
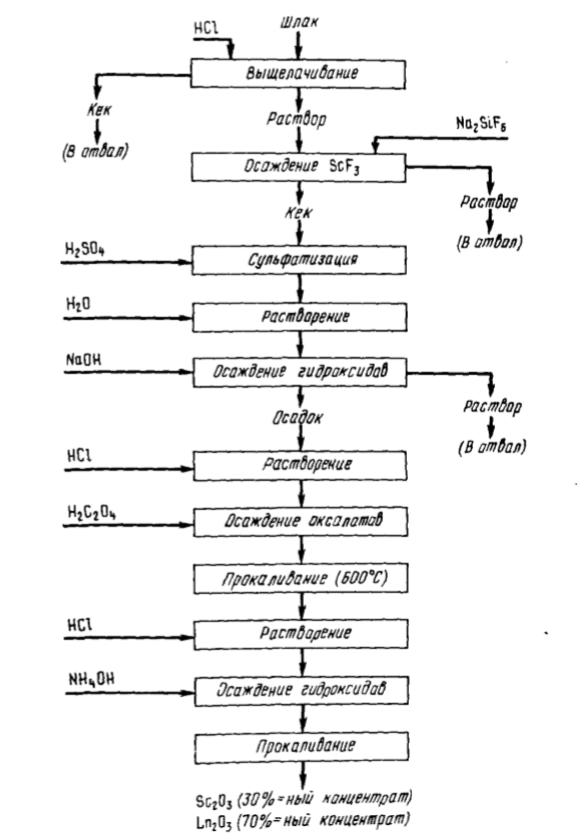
Технологические схемы извлечения скандия из этих видов сырья разработаны в СССР. В результате пирометаллургической переработки вольфрамитовых концентратов на ферровольфрам и переплавки оловосодержащих концентратов получают шлаки, в которых содержание скандия составляет 0,04 – 0,25 %. Основные примеси – Fe, Si, Al, Ca, Ti, Mn, иногда Th, РЗЭ. Из обоих видов шлаков извлекать скандий предложено, обрабатывая измельченный материал 18 %-ной HCl при 80 – 90 °С (Т:Ж = 1:1÷5). В раствор извлекается до 96% Sc. Для отделения от основных количеств железа и марганца скандий осаждают в составе малорастворимого фторида путем введения в раствор кремнефторида натрия при pH =2. Осадок фторида скандия, содержащий Ca, Al, РЗЭ, Ti, Mn, обрабатывают серной кислотой, а затем проводят водное выщелачивание. Часть кальция остается нерастворимой в составе CaSO4. Для отделения алюминия и осадков кальция осаждают гидроксиды, вводя NaOH, при pH = 10. Указанные примеси остаются в растворе; в осадок вместе с Sc(OH)3 выделяются титан, марганец и другие примеси. Осадок гидроксидов растворяют в соляной кислоте и осаждают скандий щавелевой кислотой. Прокаливанием оксалаты переводят в оксиды. После растворения в HCl, осаждения гидроксидов, их прокаливания получают концентрат, содержащий 30 % Sc2O3 и 70 % (РЗЭ)2O3. Извлечение из шлака ~76 %. Схема процесса приведена на рис. 92.
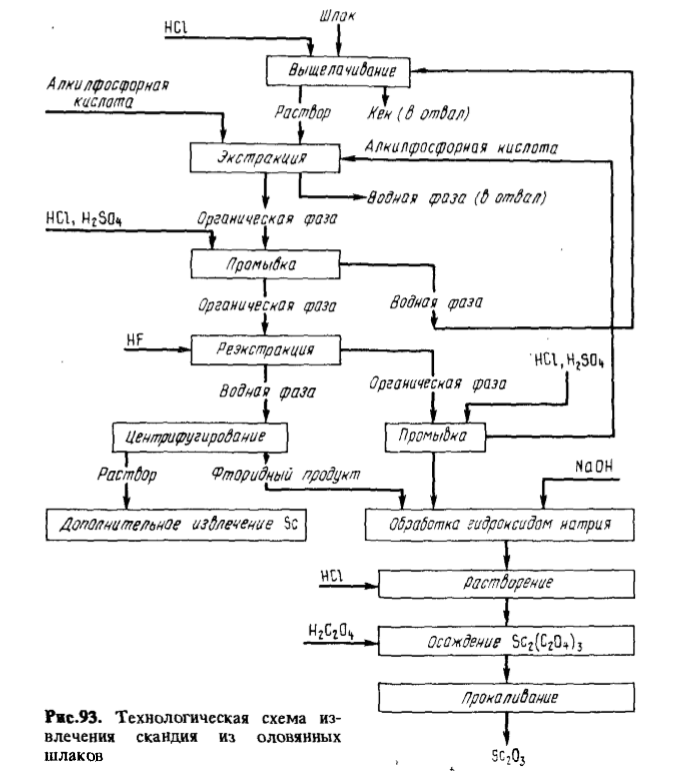
Разработан и проверен в промышленных условиях метод экстракционного концентрирования и очистки скандия, получаемого из шлаков от переплавки оловянных концентратов. Схема процесса приведена на рис. 93. После выщелачивания шлака соляной кислотой получают раствор, содержащий, г/л: Sc 0,2 – 1,0, Ti 0,8 – 3, Si 0,1 – 2, Са 11 – 30, Sn 0,1 – 1, Al 3,5, Mg 0,5 – 1,6, Zr до 2,6, Fe 0,5 – 2, W 0,03, HCl 110. Скандий экстрагируют 0,3 M Д2ЭГФК в керосине при соотношении объемов водной и органической фаз 10:1. Органическую фазу промывают 15 %-ной HCl при соотношении фаз 1:1, а затем 45 %-ной H2SO3 при таком же соотношении фаз. Скандий реэкстрагируют плавиковой кислотой. После отделения центрифугированием фторид обрабатывают раствором NaOH, переводя в Sc(OH)3; затем проводят оксалатную очистку. Прямое извлечение скандия – 75 %.
Получение скандия
Металлический скандий впервые получен в 1937 г. В.Фишером электролизом расплава хлоридов скандия, калия и лития при 700 – 800 °С на жидком катоде из химически чистого цинка. Из сплава цинка с 2 % Sc цинк отгоняли в вакууме. В результате получили губчатый скандий чистотой 94 – 98 %, содержавший железо и кремний.
В настоящее время скандий получают в основном металлотермическим способом путем восстановления безводного ScF3 или ScCl3 магнием или кальцием в инертной атмосфере (ΔG°298ScCl2 = -857 кДж/моль; ΔG°298CaCl2 = -727 кДж/моль):
2ScCl3 + 3Са = 3СаCl2 + 2Sc (12.11)
Процесе ведут в тиглях из тантала или молибдена. В связи с тем, что скандий и шлак разделяют при температуре выше 1600 °С, фторид скандия восстанавливают вначале при 850 °С, повышая в конце процесса температуру до 1600 °С. После отделения шлака металл переплавляют в вакууме 10-3 Па для удаления остатков летучих примесей. Сохраняя тот же вакуум, возгоняют скандий при 1700 °С. Выход чистого металла достигает 95 %. Чтобы уменьшить загрязнение скандия танталом, рекомендуется добавлять металлы, образующие со скандием сплавы и позволяющие проводить восстановление при более низкой температуре. При магниетермическом восстановлении берут избыток магния для образования сплава Sc- Mg. При восстановлении кальцием вводят дополнительно цинк, поскольку сплав Sc – Са не образуется. Для понижения температуры плавления шлака вводятLiF. Схема восстановления:
2ScF3 + 3Ca + 8Zn + 12LiF = 2(Sc • 4Zn) + 3(CaF2 – 4LiF) (12.12)
Процесс ведут в аргоне при 1100 °С. Цинк и примесь кальция отгоняют в вакууме. Губку скандия переплавляют. Известен также способ восстановления ScF3 алюминием:
ScF3 + 3Al = Sc + 3AlF
Реакция начинается при 810 °С. Полное восстановление скандия происходит при 930 °С через 7 – 8 мин. Восстанавливая хлорид скандия кальцием при 900 °С в среде аргона, можно получить металл, загрязненный примесями Са, СаО, СаCl2, Si, ScCl3. Примеси за исключением кремния отмываются водой. Кремний отделяют обработкой 10 %-ным раствором NaOH. Высушенный на воздухе, а затем в вакууме (10-2 Па) металл после плавления в вакууме (10-3 – 10-4 Па) при 500 – 600 °С имеет чистоту 97 – 97,5 %. Более высокая степень чистоты (более 99 %) достигается дистилляцией в вакууме (10-4 Па).
Известен способ получения скандия электролизом расплава фтороскандата натрия, в котором растворено 2 % Sc2O3 при 800 °С в среде аргона. Выделяющийся металл непрерывно механически отделяют; в электролит добавляют необходимое количество фтороскандата натрия и оксида скандия.