Принципиальные схемы производства металлов
Металлургическим процессом называется получение металлов, сплавов, химических соединений металлов, а также металлосодержащих промежуточных продуктов.
Исходным сырьем для производства большинства металлов являются руды, для переработки которых разрабатывают технологическую схему металлургического передела, т.е. последовательность и оптимальные условия процессов, при которых достигаются наиболее высокие технико-экономические показатели по себестоимости и качеству металла.
Существуют сотни разнообразных технологических схем получения металлов, но принципиальная сущность всех схем одна – отделение металла от пустой породы и сопутствующих элементов. Весь комплекс операций, входящих в технологические схемы, целесообразно разделить на четыре стадии, в каждой из которых решается определенная задача:
- первая стадия – получение рудного концентрата механическими способами (дробление, измельчение, обогащение);
- вторая стадия – получение “химического” концентрата (обжиг, спекание-разложение, растворение, осаждение, плавка и пр.);
- третья стадия – получение “чернового” металла или его химического соединения (хлорирование, ректификация, экстракция, возгонка);
- четвертая стадия – получение чистого металла (химические и физические методы очистки).
На первой стадии процесса происходит отделение рудного минерала от пустой породы методами обогащения, в результате которых руда разделяется на две части: концентрат, куда переходит основное количество рудного минерала, и хвосты, состоящие главным образом из пустой породы.
На второй стадии схемы производят удаление оставшегося количества пустой породы химико-металлургическими методами. Итогом этой стадии является получение либо химического соединения данного металла, либо металлического сплава.
На третьей стадии в одних схемах получают «черновой металл (загрязненный примесями), в других – чистое химическое соединение металла, которое является исходным материалом для получения чистого металла на последней стадии.
На четвертой стадии получают чистый металл восстановлением соответствующего химического соединения или путем очистки «чернового» металла.
Получение металлов – задача трудная, и она существенно усложняется при переработке бедного или полиметаллического сырья. Наиболее сложные технологические схемы характерны для получения цветных металлов.
Металлургические процессы и их классификация
В основе любого металлургического процесса лежит перевод перерабатываемого сырья в гетерогенную систему, состоящую из двух, трех и более фаз, отличающихся между собой составом и физическими свойствами, и не растворяющихся друг в друге. При этом одна из фаз обогащается извлекаемым металлом и обедняется примесями, а другие фазы, наоборот, обедняются основным компонентом.
В практике металлургического производства наиболее часто встречаются следующие комбинации фаз: Г + Ж; Г + Т; Ж + Ж; Ж + Т; Г + Ж + Ж; Г + Ж + Т, где буквами Г, Ж, и Т соответственно обозначены газовая, жидкая и твердая фазы.
Разделение системы Г + Т и Г + Ж вследствие большого различия плотностей осуществляют отстаиванием. Фазы систем Ж + Ж не растворимые друг в друге также могут разделяться отстаиванием или центрифугированием Для системы Ж + Т применимы отстаивание, центрифугирование или фильтрование при температурах до 400 °С. Двухфазные системы Г + Г используются в химических производствах, а системы Т + Т разделяют методами обогащения.
Все используемые в металлургии процессы подразделяются на пирометаллургические и гидрометаллургические.
К пирометаллургическим (от греческого pyr – огонь) относятся процессы, проводимые при высоких температурах чаще всего с расплавлением перерабатываемого материала. Гидрометаллургические (от греческого hydro – вода) процессы проводятся в жидких средах при температурах не более 300 °С. Электрометаллургические процессы могут относиться как к пирометаллургическим, так и к гидрометаллургическим, но их отличием является использование электричества в качестве энергетической основы для их протекания.
Пирометаллургические процессы
Эти процессы по назначению, характеру протекающих в них физико-химических изменений и конечным результатам можно разделить на три группы: обжиг, плавка и дистилляция.
Обжиг
Это в основном твердофазные процессы, проводимые при температуре 500–1200 °С с целью изменения фазового состава перерабатываемого сырья. В металлургии применяются следующие виды обжига:
Кальцинирующий обжиг (прокалка) проводится с целью разложения неустойчивых соединений под воздействием температур. Примером этого процесса может служить кальцинация магнезита
![]()
Восстановительный обжиг проводят с целью частичного восстановления компонентов перерабатываемого сырья, например,
![]()
Окислительный обжиг применяют для полного или частичного перевода сульфидных руд и концентратов в оксиды. В общем виде окислительный обжиг описывается следующим уравнением:
![]()
где Me – Fe, Pb, Zn, Ni и др.
К окислительному обжигу относится и агломерирующий обжиг (обжиг со спеканием), при котором сульфидный материал одновременно окисляется и превращается в прочный кусковый продукт – агломерат. Применяются и некоторые другие виды обжига.
Плавка
Пирометаллургический процесс, проводимый в плавильных печах при температурах, обеспечивающих получение продуктов плавки в расплавленном состоянии. Различают две разновидности плавки, рудную и рафинировочную.
Рудная плавка
Рудная плавка подразделяется на следующие виды:
Восстановительная плавка – процесс получение металлов за счет восстановления его оксидов углеродистыми восстановителями или водородом и перевода пустой породы в шлак. Этим способом получают многие металлы – свинец, олово и. т. д. Реакцию восстановления оксидов металла углеродом, например, оксида свинца, можно записать следующим уравнением:
PbО + С = Рb + СО.
Подобные реакции идут вправо – в сторону восстановления металла, если прочность химической связи кислорода с углеродом в оксиде углерода больше прочности связи кислорода с металлом. Прочность химических связей называют сродством и характеризуют в химической термодинамике величиной изобарно–изотермического потенциала, обозначаемого символом ∆Z. Изобарный потенциал измеряют в джоулях. Физический смысл его – максимальная работа, которую может совершить реакция. Эту работу условно считают отрицательной, поэтому отрицательная величина ∆Z указывает на работоспособность реакции – возможность самопроизвольного ее протекания.
Сродство какого-либо элемента к кислороду или сере (изобарный потенциал образования оксида или сульфида) зависит от температуры. Эта зависимость выражается уравнением вида:
∆Z = A + BТ lgT+CT+…,
где А, В, С – коэффициенты, определяемые из опыта; Т – абсолютная температура, °К.
Зависимость сродства от температуры по этим уравнениям можно представить графически, как это сделано на (рис. 4), где величина ∆Z дана на один моль кислорода, участвующего в реакции образования оксида. Воспользовавшись графиком, вычислим изобарный потенциал реакции восстановления оксида свинца углеродом при 800° С.
Восстановление PbО можно представить разностью двух реакций – II и I:
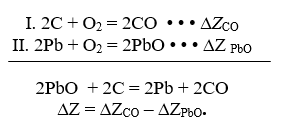
По графику рис. 4 находим:
∆Z PbО = – 250 кДж; ∆ZCO = – 400 кДж; ∆Z = – 400 + 250 = – 150 кДж.
Разность получилась отрицательной, следовательно, реакция пойдет вправо, свинец будет восстанавливаться. Линии РbО и СО на рис. 4 пересекаются при температуре около 320 °С. За точкой пересечения влево разность сродства окажется положительной, эта точка определяет температуру начала восстановления свинца углеродом.
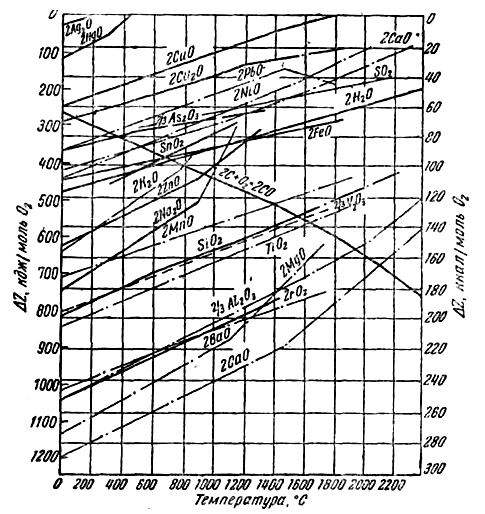
Так же по точкам пересечения соответствующих линии можно определить температуры начала восстановления углеродом других оксидов. Для SiO2, Al2O3, CaO, MgO они выше 1500 °С.
Следовательно, можно выбрать такие температуры, при которых одни оксиды восстанавливаются до металла, а другие остаются неизменными. На этом основана, например, выплавка свинца из руд, содержащих SiO2, FeO, CaO и Аl2О3. При плавке руды с коксом восстанавливается только свинец, имеющий сравнительно малое сродство к кислороду. Другие оксиды сплавляются в жидкий шлак. Шлак с плотностью 3000–3500 кг/м3 всплывает над жидким свинцом (γ 10000 кг/м3) подобно тому, как слой масла всплывает над водой. Очень важна скорость восстановления: металлургические переделы должны быть производительными, а для этого надо, чтобы входящие в них реакции протекали быстро.
Восстановление твердых оксидов твердым углеродом происходит медленно из-за малой поверхности контакта реагирующих веществ. Даже при тонком измельчении частицы оксидов и углерода соприкасаются неплотно. К тому же продукт реакции – металл, получающийся в местах соприкосновения, прекращает реакцию в данной точке (рис. 5).
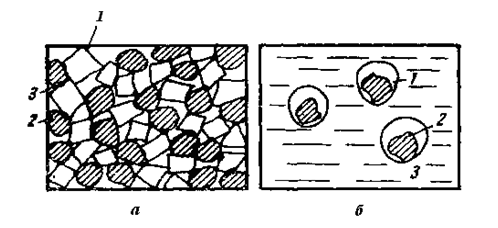
Твердый углерод может быть энергичным восстановителем только в том случае, если зерна его омываются жидким или парообразным оксидом. Если же оксиды находятся в твердом состоянии, они быстро восстанавливаются газообразным оксидом углерода:
МеО + СО = Me + СО2.
Оксид углерода получается по реакции
С + СО2 = 2СО.
В расплавах, плохо смачивающих углерод, а такие встречаются часто, частицы углерода окружены газовой пленкой, состоящей из СО и СО2. Восстановление здесь происходит также в результате взаимодействия между С и СО2.
Водород для восстановления оксидов применяют реже, он дороже и взрывоопасен. Водород бывает, необходим в тех случаях, когда углерод может образовать с металлами нежелательные карбиды, например при восстановлении вольфрама и молибдена из оксидов по реакциям:
WO3 + 3С = W + 3СО,
МоО3 + 3С = Мо + 3СО.
Одновременно с восстановлением образуются карбиды WC и Мо2С.
Многие металлы представлены в природе сульфидами. Для оценки возможности восстановления сульфидов углеродом по реакции:
2MeS + С = 2Ме + CS2
рассмотрим рис. 6, характеризующий сродство элементов к сере.
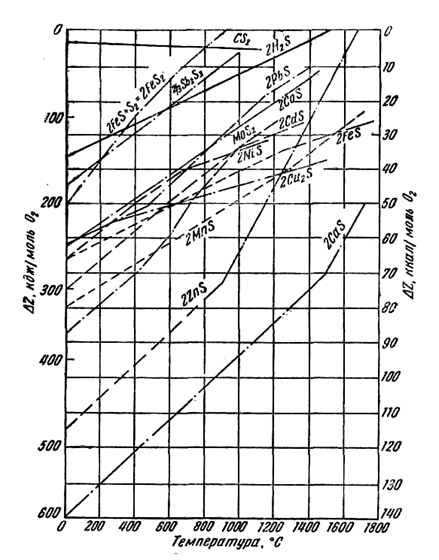
В большинстве случаев углерод не пригоден для непосредственного восстановления металлов из сульфидов. Также мало пригоден для этого и водород: линия H2S расположена высоко, что указывает на невозможность реакции типа:
MeS + Н2 = Me + H2S.
В металлургической практике природные сульфиды металлов сначала переводят в оксиды, которые затем восстанавливают углеродом. Например, сульфид свинца – галенит окисляют кислородом воздуха при температуре около 1000 °С:
2PbS + 3О2 = 2РbО + 2SO2.
Образовавшийся при этом оксид свинца восстанавливают углеродом.
По подобным реакциям получают из сульфида цинк. на рис. 4 линия ZnO имеет излом, соответствующий точке кипения металла при 907 °С. Восстанавливаясь при температуре около 1200 °С, цинк получается в виде паров, которые отводят из печи, охлаждают и таким образом конденсируют в виде жидкого или твердого металла (в зависимости от температуры в конденсаторе).
Металлотермическая плавка – это процессы получения металлов путем восстановления их соединений более активными металлами. Ее применяют для получения трудно восстановимых металлов, например, тетрахлорид титана TiCl4 и тетрафторид урана UF4, а также некоторые оксиды тугоплавких металлов: V2O5, Сr2О3 и др. Металлы из них восстанавливают другими, более дешевыми металлами, имеющими большее сродство к галогену или кислороду, чем восстанавливаемый металл. Титан восстанавливают магнием по реакции:
TiCl4 + 2Mg → Ti + 2MgCl2.
Уран восстанавливают магнием или кальцием:
UF4 + 2Ca → U + 2CaF2;
UF4 + 2Mg → U + 2MgF2,
а ванадий – алюминием:
3V2O5 + 10Аl → 6V + 5Аl2О3.
Многие из подобных реакций протекают с выделением большого количества тепла, которого бывает достаточно для расплавления даже таких тугоплавких металлов, как ванадий, хром или марганец. Отсюда и название способа – металлотермия. Для проведения металлотермической реакции достаточно приготовить смесь порошков реагирующих веществ и поджечь ее особым запалом, например, из порошка магния и КСlО3. Реакционная смесь разгорается, а затем плавится от тепла, выделяемого реакцией. Эти процессы, не требующие внешнего подогрева, называются внепечной металлотермией. В иных случаях, когда тепла, выделяемого реакцией, недостаточно для плавления, приходится применять внешний подогрев в печах, эти процессы называются печной металлотермией.
Металлотермические способы дороги: для восстановления одного металла приходится сжигать другой металл; они применяются только при непригодности других способов восстановления.
Плавка на штейн – это процессы переработки медного и никелевого сырья с целью извлечения металлов в полупродукт, называемый штейном (сплав сульфидов), и перевода оксидов в шлак.
Этот вид плавок можно проводить в нейтральной, восстановительной и окислительной атмосфере. В последнем случае плавки называют концентрационными, так как они позволяет концентрировать извлекаемый металл в меньшем объеме богатого (концентрированного) штейна. Ниже приведена схема плавки медного сырья на штейн:
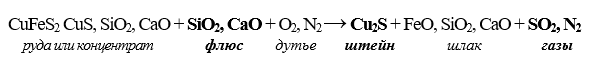
Окислительная плавка – эти процессы проводятся в окислительной атмосфере. Примером таких плавок может служить конвертерный процесс получения стали из чугуна при температуре 1600 °С. Вначале окисляется железо, присутствующее в расплаве, с выделением большого количества тепла
2Fe + О2 = 2FeO + 539800 кДж,
а затем окисляются примеси:
Mn + FeO = MnO + Fe;
Si + 2FeO = SiO2 + 2Fe;
С + FeO = CO + Fe;
2P + 5FeO = P2O5 + 5 Fe.
Реакционная плавка – эти процессы основаны на получении металлов в результате химических реакций между сульфидами и оксидами, например, между сульфидом меди и оксидом меди (I):
Cu2S + 2Cu2O = 6Cu + SO2.
Чтобы подсчитать изобарный потенциал этой реакции, придется воспользоваться рис. 4 и 6. Для 1200 °С найдем:
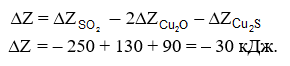
Подобным способом иногда восстанавливают из оксидов свинец при температуре около 800 °С. Условием реакционных плавок является сравнительно малое сродство металлов и к кислороду, и к сере.
Электролитическая плавка (электролиз расплавленных солей) – процессы ведутся при воздействии постоянного тока на расплавленную среду, состоящую из оксидов или хлоридов. В общем виде эти процессы описываются следующей схемой:
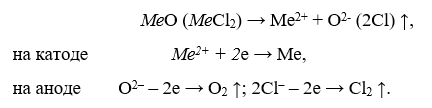
В результате на катоде выделяется металл, а на аноде газ. Электролиз расплавленных солей применим для любого металла, но вследствие дороговизны он находит применение только тогда, когда другие процессы не могут быть использованы. В настоящее время этим способом получают алюминий, магний и ряд других легких и редких металлов.
Например, минерал магния – магнезит сначала обжигают для удаления углекислоты:
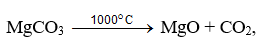
затем оксид магния хлорируют:
MgO + Сl2 + С = MgCl2 + СО.
Расплавленный хлористый магний при температуре около 700 °С подвергают электролизу. В расплаве эта соль состоит из ионов Mg2+ и Сl–. На отрицательном электроде – катоде ионы магния приобретают два электрона и восстанавливаются до металла. Температура плавления магния 651 °С, поэтому он получается в жидком состоянии и вследствие меньшей плотности, чем электролит, всплывает над ним:
Mg2+ + 2e → Mg (ж).
На положительном электроде – аноде ионы хлора отдают два электрона, превращаясь в молекулы газообразного хлора:
2Сl– – 2е → Сl2.
Алюминий получают электролизом окиси Аl2О3, растворенной в расплавленном криолите Na3AlF6. Окись алюминия диссоциирует, подобно соли, растворенной в воде:
Аl2О3 ⇄ 2Аl3+ + 3O–.
На катоде:
2Аl3+ + 6е → 2Аl;
на аноде:
3О– – 6е → 11/2О2.
Криолит служит только растворителем и при электролизе не расходуется.
Подобно магнию, из хлоридных и фторидных расплавов получают щелочные металлы, кальций и барий. Заметим, что для восстановления этих металлов углеродом потребовались бы очень высокие температуры, выше 1800 °С (см. рис. 4).
Рафинировочная плавка
Эти процессы проводят с целью очистки (рафинирования) металлов от примесей. Существуют несколько разновидностей рафинировочной плавки.
- Окислительное (огневое) рафинирование – процессы основаны на различии в сродстве к кислороду основного металла и примесей. Образующиеся оксиды примесей всплывают из расплава в шлак или улетучиваются в газовую фазу. Например, этим способом рафинируют черновую медь от серы.
- Ликвационное рафинирование – процессы проходящие при образовании и разделении по плотности (ликвации) двух фаз, одна из которых является рафинируемым металлом, а примесь концентрируется в другой, нерастворимой в основном металле, фазе. Этот вид рафинирования находит широкое применение при производстве свинца и олова.
- Электролитическое рафинирование в расплавах. Эти процессы основаны на переносе рафинируемого металла с жидкого анода на жидкий катод через слой расплавленного электролита и широко используется для рафинирования алюминия.
- Карбонильное рафинирование – процессы основаны на способности некоторых металлов при определенных температурах, образовывать летучие соединения типа Мех (СО)у, называемые карбонилами. Примером такого процесса является рафинирование никеля от меди, протекающее по схеме:

- Дистилляция – процессы испарения веществ при нагреве несколько выше температуры их кипения, позволяющие разделить компоненты обрабатываемого материала в зависимости от их летучести. Эти процессы используются как при переработке рудного сырья, так и для удаления легколетучих примесей при рафинировании сплавов. Дистилляцию используют в пирометаллургии цинка и при получении легких и редких металлов.
Гидрометаллургические процессы
Гидрометаллургия – извлечение элементов из полиметаллического сырья с помощью жидкофазных растворителей и последующее выделение их из растворов в форме металлов или моноосадков.
Гидрометаллургические процессы применяются для извлечения металлов из руд, концентратов и отходов различных производств при обработке их жидкофазными растворами химических реагентов при температуре не более 300 °С с последующим выделением металлов или их соединений из полученных растворов.
Основные стадии гидрометаллургической технологии:
- Подготовка сырья – эта стадия способствует более быстрому, полному, селективному выщелачиванию ценного металла. Известны механические способы (дробление, измельчение) и физико–химические (прокалка, обжиг, спекание, гидротермальное активирование и т.д.).
- Выщелачивание – это процесс селективного извлечения одного или нескольких компонентов перерабатываемого сырья в водный раствор под воздействием растворителя, в качестве которого используют воду, растворы кислот, щелочей и солей. Основными продуктами выщелачивания являются раствор, содержаний извлекаемый металл, и нерастворимый остаток (кек), состоящий в основном из пустой породы. Разделяют два вида процесса выщелачивания: простое растворение и растворение с химической реакцией.
При простом растворении извлекаемый металл переводится в раствор в виде того же соединения, в котором он находился в исходном материале. Хорошо растворяются в воде многие хлориды (NaCl, KCl, MgCl2∙KCl∙6H2O) и сульфаты (CuSO4, ZnSO4).
Выщелачивание с химической реакцией – наиболее частый вид растворения, при котором переход металла в раствор сопровождается переводом его из малорастворимого соединения в хорошо растворимую форму под действием растворителя. Примером может служить растворение оксида цинка из обожженных концентратов в растворе серной кислоты:
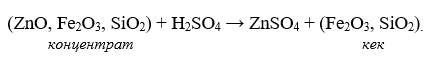
- Подготовка раствора, которая включает в себя:
а) очистку раствора от посторонних примесей физико–химическими методами (осаждение в виде труднорастворимых соединений, цементация, сорбционно–экстракционное разделение);
б) концентрирование растворов приемами упаривания, сорбции и экстракции с последующим получением при десорбции и реэкстрации обогащенной водной фазы.
Очистка раствора проводится для уменьшения попадания примесей в металл при последующем его выделении. Для этого используют методы химического осаждения органическими и неорганическими реагентами, а также цементацию, в основе которой лежит принцип вытеснения одного металла другим, более электроотрицательным. Например,
CuSO4 + Zn → Сu +ZnSO4;
CuSO4 + Ni → Cu + NiSO4.
- Осаждение металлов из очищенных растворов от выщелачивания может быть проведено электролизом водных растворов, цементацией или восстановлением газообразными восстановителями под давлением. Для осаждения металлов в виде химических соединений применяют гидролитический и химический способы, а также выпаривание растворов или их охлаждение.
В гидрометаллургии цветных металлов, особенно благородных и редких, все большее применение приобретают сорбционные (ионообменные) и экстракционные процессы.
Ионообменные процессы основаны на способности некоторых твердых веществ (ионитов) поглощать из раствора ионы в обмен на ионы того же знака, входящие в состав ионита. В качестве ионитов используют синтетические высокомолекулярные вещества (ионообменные смолы).
Экстракция – процессы извлечения растворенных химических соединений металлов из водных растворов в жидкую органическую массу, не смешивающуюся с водой.