Для получения водорода в данный момент существует множество различных путей из ряда известных источников, как показано на рисунке 1.3.
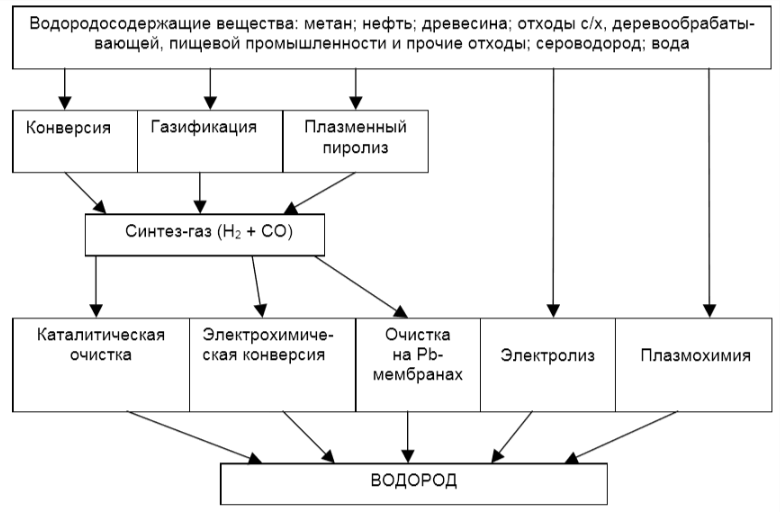
Среди источников получения водорода можно выделить природное топливо: метан, уголь, древесина, нефтепродукты, техногенные горючие газы. При взаимодействии топлива с парами воды или воздухом образуется синтез-газ — смесь СО и Н2. Из нее затем выделяется водород. Другой источник — отходы сельскохозяйственного производства, из которых получают биогаз, а затем — синтез-газ. Промышленнобытовые отходы тоже используются для производства синтез-газа, что способствует одновременно и решению экологических проблем, поскольку отходов много и их нужно утилизировать. В конечном счете образуются углекислый газ, водород и окись углерода.
Дальше идет каталитическая очистка, электрохимическая конверсия и т. д. Очень важным элементом при преобразовании газа, содержащего водород, является очистка газа на палладиевых мембранах. В конечном счете получается чистый водород. Водород можно получать также электролизом воды, то есть разложением ее под воздействием электрического тока, получаемого от различных источников энергии. Для получения электрической энергии используются ветровой генератор, фотогальванические элементы, сеть переменного тока и энергия солнца, которые являются возобновляемыми источниками. В дальнейшем полученный водород поступает в системы хранения или транспортируется к потребителям.
Технологии получения водорода
В настоящее время разработано множество способов производства водорода.
Для получения водорода его не нужно добывать, необходимо разорвать химические связи в углеводородах или воде и выделить его из реакционной смеси. Одним из устройств для получения водорода является паровой реформер, для которого существуют различные варианты питания. На рисунке 1.4 приведены варианты питания реформера.
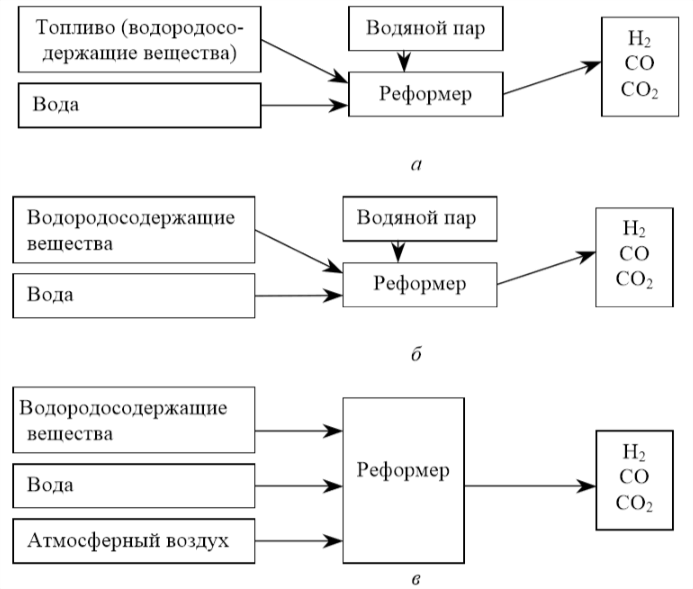
На рисунке 1.4, а показан вариант питания реформера при паровом преобразовании. При преобразовании пара топливо реагирует с водой и высокой температурой, чтобы произвести водород. Частично окисляясь, топливо реагирует с воздухом, создавая высокую температуру в процессе, как показано на рисунке 1.4, б. Автотепловое преобразование (рис. 1.4, в) объединяет два процесса.
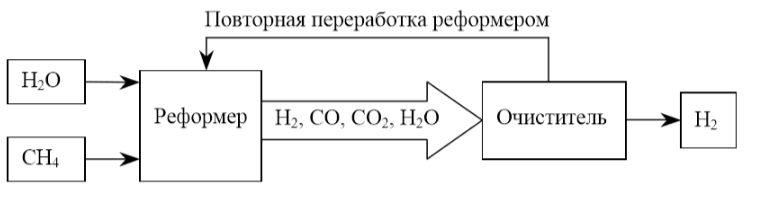
На рисунке 1.5 представлено моделирование производства, очистки и модулей сжатия водорода.
Способы получения водорода
Конверсия природного газа
В настоящее время крупнотоннажное производство водорода и водородосодержащих продуктов осуществляется в мире в основном путем паровой конверсии метана, являющегося основным компонентом природного газа и содержащего 25 % водорода. Чтобы отделить водород от углеродной основы в метане, требуются пар и тепловая энергия при температурах 750—850 °С, что и происходит в химических паровых реформерах на каталитических поверхностях.
Первый шаг реакции расщепляет метан и водяной пар на водород и монооксид углерода (синтез-газ):
СН4 + Н2О ↔ СО + 3Н2 ‒ 206 кДж/моль.
Выход водорода увеличивается благодаря дополнительной реакции СО с водой при пониженных температурах в присутствии катализаторов. «Реакция сдвига» превращает монооксид углерода и воду в диоксид углерода и водород:
СО + Н2О ↔ СО2 + Н2 + 44 кДж/моль.
Эта реакция происходит при температурах 200—250 °С.
При осуществлении указанных реакций может быть извлечено около 96 % водорода, а необходимая теплота процесса получается при сжигании части природного газа. Производительность подобных установок достигает 4—12 тыс. м3 водорода в час.
С целью экономии природного газа и снижения загрязнения окружающей среды продуктами его сгорания, в России, США и Японии проводились и продолжают проводиться разработки технологии паровой конверсии метана с подводом тепла от высокотемпературного гелиевого реактора (ВТГР). Высокотемпературные реакторы с гелиевым теплоносителем способны вырабатывать тепло с температурой около 1000 °С, которое может быть использовано для производства электроэнергии с высоким КПД в прямом газотурбинном цикле и для снабжения высокотемпературным теплом и электричеством процессов производства водорода, технологических процессов химической, нефтеперерабатывающей, металлургической и других отраслей промышленности и опреснения воды. Такой комплекс состоит из ядерной части, вырабатывающей синтез-газ, который транспортируется к технологической части производства, где применяется для выработки конечной продукции.
Возможно использование и жидкометаллических быстрых реакторов. Например, действующий российский реактор БН-600 имеет параметры пара на выходе из РБН (13,2 МПа и 500 °С), близкие к тем, которые требуются для конверсии метана.
Для достижения полного соответствия температуры пара рабочей температуре 850 °С предлагается осуществить дополнительный нагрев парогазовой смеси сжиганием части подводимого к реформеру природного газа.
В дальнейшей перспективе, в случае создания высокотемпературных (800—850 °С) быстрых реакторов со свинцовым теплоносителем, доля сжигаемого углеродного топлива может быть сокращена или полностью замещена атомным теплом.
В РНЦ «Курчатовский институт» выполнены исследования плазменной конверсии метана в синтез-газ. Эта технология может быть применена на заправочных станциях или на борту водородных автомобилей при использовании обычного жидкого или газообразного топлива.
В настоящее время паровая конверсия метана является наиболее рентабельным способом производства водорода.
В последние годы особое внимание обращают еще на один важный природный источник метана — Мировой океан. Когда метан, поднимаясь из недр земли, встречается с водой, просочившейся сквозь трещины земной коры, он сразу остывает. При этом образуется вещество, похожее на лед, — гидрат метана. Это горючее вещество, его запасы превышают запасы нефти, угля и природного газа, вместе взятые.
В условиях истощения запасов привычных видов топлива оно может сыграть весьма положительную роль в энергетике, но его использование может привести к изменению климата. Хранилища метангидрата не только труднодоступны, но и таят опасность неконтролируемого внезапного выхода метана на поверхность океана в случае нарушения сохраняющегося в них равновесия внешних и внутренних параметров. Такой риск существует даже в условиях естественно протекающих природных процессов и возрастает в связи глобальным потеплением.
Газификация угля
Газификация — процесс высокотемпературного взаимодействия горючих ископаемых, в рассматриваемом случае — угля, с парами воды, кислородом, диоксидом углерода или их смесями, с целью получения горючих газов: Н2, СО, СH4. Они могут использоваться как топливо и как сырье для химической промышленности. Газифицироваться могут практически все виды газообразных, жидких и твердых топлив. Выбор сырья для процесса обычно бывает обусловлен экономическими соображениями, а иногда — направлением дальнейшей переработки образующейся газовой смеси.
Процессы, в которых образуются смеси продуктов газификации, очень разнообразны и составляют сложную систему последовательно-параллельных обратимых и необратимых реакций, среди которых есть и экзо-, и эндотермические.
Считается, что реакциям собственно газификации предшествует пиролиз угля с выделением летучих веществ и образованием твердого обуглероженного остатка (кокса). Газифицирующие агенты реагируют затем с газообразными продуктами пиролиза и частицами кокса. Большая часть этих реакций обратима, за исключением окислительных, проходящих с участием молекулярного кислорода.
В настоящее время распространен способ производства водорода из водяного и паровоздушного газов, получаемых газификацией угля. Процесс основан на конверсии окиси углерода. Водяной газ содержит до 50 % Н2 и 40 % СО; в паровоздушном газе, кроме Н2 и СО, имеется значительное количество N2, который используется вместе с получаемым водородом для синтеза NН3. Из коксового газа водород выделяют путем удаления остальных компонентов газовой смеси, сжижаемых более легко, чем водород, при глубоком охлаждении.
Процесс превращения твердого топлива в горючий газ известен с 1670 г. За последние 150 лет техника газификации достигла высокого уровня и широко развита. В настоящее время существует более 70 типов газогенераторных процессов, часть которых используется в промышленных масштабах. Это объясняется прежде всего различием физических и химических свойств угля из разных месторождений: по элементарному составу, происхождению, содержанию летучих веществ, содержанию и составу золы, влажности, соотношению Н/С в угольной массе, спекаемости углей, их термической стойкости. Не менее существенным является и различие во фракционном составе добываемых углей: крупнокусковой уголь, угольная мелочь, топливная пыль.
Наконец, различаются требования к получаемому конечному продукту:
- генераторный (энергетический) газ с теплотой сгорания 3800—4600 кДж/нм3;
- синтез-газ (технологический) для химической технологии с теплотой сгорания 10 900—12 600 кДж/нм3;
- восстановительный газ (для металлургических и машиностроительных производств) с теплотой сгорания 12 600—16 800 кДж/нм3;
- городской газ (отопительный) с теплотой сгорания 16 800— 21 000 кДж/нм3;
- синтетический природный (богатый) газ для транспортировки на дальние расстояния — 25 000—38 000 кДж/нм3.
При всем своем многообразии процессы газификации делят на два основных класса:
- Автотермические процессы газификации, в которых тепло, необходимое для проведения эндотермических процессов, для нагрева газифицируемого материала и газифицирующих средств до температуры газификации (900—1200 °С), производят за счет сжигания в кислороде части газифицируемого топлива до диоксида углерода. В автотермических процессах сжигание части топлива и газификация протекают совместно в едином газогенераторном объеме.
- Аллотермические процессы газификации, в которых сжигание и газификация разделены, и тепло для обеспечения прохождения процесса газификации подводится через теплопередающую стенку внутри единого газогенераторного объема или при помощи автономно нагретого теплоносителя, который вводится в газифицируемую среду.
Как автотермические, так и аллотермические процессы газификации в зависимости от зернистости топлива могут протекать в плотном и «кипящем» слоях (крупнокусковое топливо), в аэрозольном потоке (топливная пыль). Эти принципы проведения гетерогенных процессов, разработанные в газогенераторной технике, получили широкое применение в химической технологии при проведении, например, гетерогенных каталитических процессов.
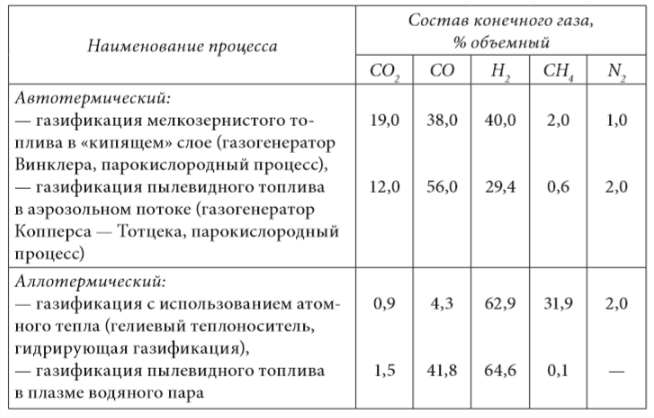
Типичные составы газов, полученных в автотермических и аллотермических процессах, приведены в таблице 1.4.
Подземная газификация угля
Выбросы тепловых электростанций, использующих уголь, могут содержать естественные радионуклиды элементов. Эти радиоактивные элементы есть и в золе, выбрасываемой через трубы вместе с дымовыми газами. Если дымовые газы очищать от золы с эффективностью даже 98,5 %, что имеет место лишь на некоторых наиболее современных ТЭС и является очень дорогостоящим процессом, то и в этом случае доза облучения, обусловленная естественными радионуклидами в выбросах тепловых электростанций, превысит аналогичную дозу, полученную населением, живущим вблизи АЭС такой же мощности, в 5 и даже в 40 раз.
Можно полагать, что единственным методом, который даст возможность использовать угольные месторождения для получения тепла и электроэнергии с большей радиационной безопасностью, является реализация идеи Рамзая — Менделеева о подземной газификации углей и очистке полученных газов в подземных газогенераторах.
Преимущество подземной газификации состоит также и в том, что в ней исключается тяжелый и очень вредный труд горнорабочих. Транспортировка, погрузка, разгрузка и дробление угля, требующие больших энергетических затрат и загрязняющие топливной пылью окружающую среду, заменяются безвредной и простой транспортировкой очищенного горючего газа в места его непосредственного использования. Подземная газификация в экологическом плане предпочтительнее и открытой добычи угля в угольных разрезах, так как при последней нарушается верхний покров Земли. Наконец, подземная газификация предоставляет широкие возможности для автоматизации процесса.
Получение водорода из аммиака
Реакция термокаталитической диссоциации аммиака имеет вид:
2NН3 ↔ М2 + 3Н2 ‒ 92 кДж/моль.
Эта реакция характеризуется достаточно высоким выходом водорода (примерно 17,6 %) на один килограмм аммиака. Массовое содержание водорода в единице объема жидкого аммиака в 1,5 раза превышает плотность жидкого водорода. Аммиак удобно хранить в емкостях в жидком состоянии, при максимальной температуре забортной воды 32 °С, под небольшим давлением порядка 1,5 МПа.
Разложение аммиака начинается при температуре 270 °С, а при температуре 900 °С он практически полностью диссоциирует.
В установках для получения водорода диссоциацией аммиака применяют катализаторы на основе окислов железа, и процесс проводят при температуре 600—700 °С. В результате диссоциации получается газовая смесь с объемным содержанием 75 % Н2 и 25 % N2 при атмосферном давлении. Энергозатраты на реакцию составляют 25—27 % от низшей теплоты сгорания получаемого водорода.
Получение водорода из метанола
Эндотермическая реакция разложения метанола происходит с использованием гетерогенного катализатора при температуре, лежащей в диапазоне 500—700 °С, и описывается уравнением:
СН3ОН ↔ СО + 2Н2 ‒ 90 кДж/моль.
Удельный выход водорода по этой реакции — 0,125 кг/кг СH3ОН. Поскольку плотность метанола достигает приблизительно 700 кг/м3, объемный выход водорода будет составлять 87 кг/м.
Для получения водорода из метанола может использоваться процесс паровой конверсии:
СH3ОН + Н2O ↔ СO2 + 3Н2 ‒ 49 кДж/моль.
Обычно для процесса применяют цинк-хромовый катализатор. Процесс протекает при 573—673 К. Метанол можно использовать как горючее для процессов конверсии. В этом случае КПД процесса получения водорода составляет 65—70 % (отношение теплоты полученного водорода к теплоте сгорания затраченного метанола); если теплота для процесса получения водорода подводится извне, то теплота сгорания водорода, полученного методом каталитического разложения, на 22 %, а водорода, полученного методом паровой конверсии, — на 15 % превосходят теплоту сгорания затраченного метанола.
К сказанному следует добавить, что при создании энерготехнологической схемы с использованием отходящего тепла и применением водорода, полученного из метанола, можно получить КПД процесса более высокий, чем при использовании указанных продуктов как синтетических жидких горючих. Так, при прямом сжигании метанола в газотурбинной установке КПД составляет 35 %, при проведении же за счет тепла отходящих газов испарения и каталитической конверсии метанола и сжигании смеси СО + Н2 КПД возрастает до 41,30 %, а при проведении паровой конверсии и сжигании полученного водорода — до 41,9 %.
Главным недостатком использования метанола как источника водорода является токсичность метанола.
Получение водорода из гидридов и боргидридов металлов
Весьма эффективным методом получения водорода из связанного состояния является гидролиз гидридов и боргидридов легких металлов. В таблице 1.5 приведены соответствующие данные для соединений, опытное промышленное производство которых можно считать освоенным.
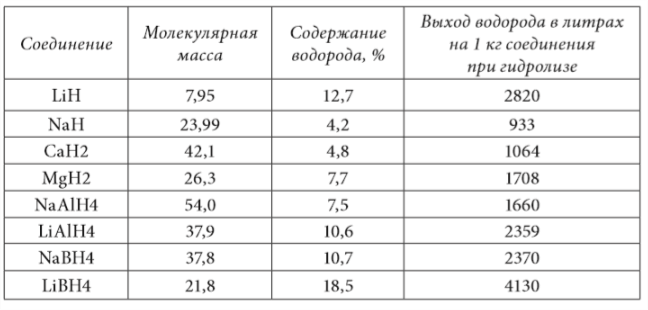
Как следует из анализа приведенных данных, наибольший выход водорода наблюдается при гидролизе боргидрида лития LiВН4. Однако использование этого вещества практически исключается из-за высокой пожароопасности, обусловленной значительной химической активностью.
Следующим по количеству выделяемого водорода элементом идет гидрид лития LiН. Ввиду того что плотность компактного гидрида лития составляет приблизительно 600 кг/м, боргидрида натрия NaВН4 — 1074 кг/м3, по объемному выходу водорода три гидрида — LiН, NaВН4 и LiАlН4 — примерно равноценны. Остальные гидриды существенно уступают перечисленным соединениям по удельному массовому и объемному выходу водорода.
Методы получения водорода из воды
Получение водорода из воды путем ее разложения гидрореагирующими металлами
При взаимодействии гидрореагирующих металлов с водой выделяется водород. Выход водорода в этих реакциях достаточно велик, и использование некоторых металлов может представлять практический интерес.
Тип реакции зависит от количества воды, а оно, в свою очередь, — от рабочих пара метров реактора (избытка воды по сравнению со стехиометрическим коэффициентом, давления, температуры).
Реакция (а) протекает при Т = 250 °С, Р = 8 МПа. Средняя скорость окисления алюминиевого порошка недостаточна для создания пригодного для использования в энергетических установках реактора.
Реакция (б) протекает при температуре Т = 300—350 °С, Р = 16—18 МПа. Реакция идет достаточно быстро и поддается регулированию. Продуктом реакции, помимо водорода, является порошок с размером частиц от 1 до 5 мкм, которые не слипаются.
Реакция (в) протекает при температуре, превышающей 300— 350 °С, давлении Р = 20—30 МПа. Продуктом реакции, помимо водорода, является порошок, состоящий в основном из Al2O3, который может образовывать твердые агломераты, плохо растворимые в воде и откладывающиеся на стенках трубопроводов. Процесс трудноуправляемый и опасный. Проведенный анализ этих процессов позволил остановиться на реакции (б).
Поскольку скорость реакции растет с увеличением степени дисперсности порошка, желательно иметь максимально возможную дисперсность. Освоенные отечественной промышленностью марки порошков представлены в таблице 1.6.
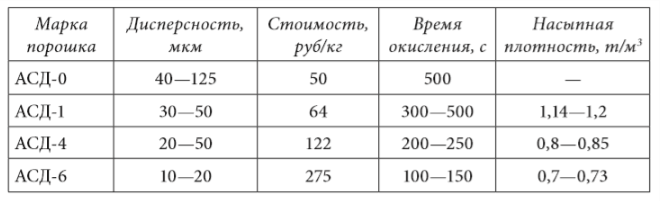
Удельный массовый выход водорода, отнесенный к 1 кг металла, составляет, согласно приведенным уравнениям, величину, приблизительно равную 11,1 % для алюминия. Это примерно в 2—3 раза ниже аналогичных значений для лучших гидридов.
Приведенные результаты свидетельствуют о том, что для транспортных установок этот метод труднореализуем вследствие неудовлетворительных массогабаритных характеристик и сложности технологической схемы установки.
Термохимическое разложение воды
Разложение воды только за счет теплоты без использования работы предполагает проведение процесса при очень высоких температурах (выше 3000 °С). Однако при связывании воды в некотором промежуточном состоянии с выделением кислорода и с дальнейшим термическим разложением удается понизить температуру данного процесса.
На этом и основаны термохимические способы получения водорода, заключающиеся в последовательном проведении нескольких химических реакций, одним из конечных продуктов которых является водород. Многостадийность процесса затрудняет его крупномасштабное промышленное осуществление. Достоинство его в том, что не требуется электроэнергии и осуществляется он при относительно невысоких температурах. Кроме того, все промежуточные реагенты в таких циклах, за исключением воды, регенерируются за счет потребляемого тепла, что удешевляет водородное топливо.
Интерес к использованию термохимических циклов объясняется перспективой получения достаточно высоких КПД (50— 60 %) в результате прямого использования теплоты высокотемпературного ядерного реактора, минуя стадию преобразования теплоты в электричество.
Однако для успешной реализации термохимического разложения воды требуются до полнительные исследования в области материаловедения, поскольку в настоящее время эта проблема окончательно еще не решена.
Электролиз воды
Разложение воды с образованием газообразного водорода и кислорода при пропускании через воду электрического тока впервые было осуществлено Риттером в 1801 г.
Из-за низкой удельной электропроводности чистой воды ее прямой электролиз неэффективен, поэтому на практике обычно применяется водный раствор КОН. Эта щелочь обладает хорошей удельной электропроводностью, которая при нормальных темпера турах и концентрации 20—40 % достигает 0,3—0,5 Ом∙см‒1, то есть в 107 раз больше, чем в случае с чистой водой.
В щелочном растворе концентрация ионов водорода невелика, в результате чего их недостаток у катода восполняется за счет диссоциации молекул воды или их прямого разряда с образованием атомов водорода и ионов ОН с последующей рекомбинацией атомарного водорода в молекулы:
2Н2O + 2е + Ме → Н2 + ОН‒ + Ме,
где Me — металл катода.
Выделение на аноде кислорода происходит в результате разряда гидроксильных ионов или молекул воды по реакциям:
2OН‒ ‒ 2е → Н2O + (½)O2;
Н2O ‒ 2е → (½)O2 + 2Н+.
Основными переносчиками тока в КОН являются положительные ионы К+ и гидроксильные ионы ОН‒.
В последнее время при электролизе воды стали активно применяться твердые электролиты на основе ионообменных мембран, в которых электропроводность обеспечивается ионами водорода или кислорода. Такой метод разложения воды называется электролизом воды с твердополимерным электролитом и имеет ряд неоспоримых преимуществ по сравнению с традиционным электролизом воды.
Электролиз воды с использованием твердополимерного электролита (ТПЭ) является одним из наиболее перспективных методов как для промышленного крупномасштабного получения водорода, так и для решения широкого ряда специальных задач.
К достоинствам этого метода можно отнести:
- небольшое расстояние между электродами (толщина ионообменной полимерной мембраны 50—300 мкм);
- довольно низкое удельное сопротивление электролита (4— 20 Ом∙см‒1);
- исключение дополнительных сепараторов газов.
Пиролиз биомассы
Процесс пиролиза может использоваться для производства водорода из биомассы, но предварительно биомасса должна быть обработана высокой температурой и давлением. Эти процедуры расчленяют и частично окисляют биомассу, которая далее очищается. Полный процесс подобен газификации угля, но тем не менее требует предварительной обработки. Для получения водорода также используются биологические организмы, производящие водород. Основными являются морские водоросли и бактерии. Морские водоросли используют обратимый фермент гидрогенес, чтобы произвести водород от протонов в анаэробных условиях.
Плазменная конверсия углеводородов
В российском научном центре «Курчатовский институт» выполнены исследования плазменной конверсии природного углеводородного топлива (метана, керосина в синтез-газ). Эта технология может быть применена на заправочных станциях или на борту водородных автомобилей при использовании обычного жидкого топлива. Разработаны также плазмохимические методы получения водорода с помощью высокочастотных и сверхвысокочастотных технологий с использованием в качестве сырья химических соединений, в которых водород находится в слабосвязанном состоянии, например сероводорода.
Технико-экономическое сравнение методов получения водорода
Из перечисленных выше способов получения водорода наиболее приемлемыми для целей энергетики являются способы получения водорода из таких видов исходного сырья, как метан, производные нефтеуглеводороды (дизельное топливо, бензин), искусственное топливо — метанол, в перспективе — каменный уголь. С этими способами конкурирует экологически более чистый, но более энергоемкий способ получения водорода — электролиз воды.
Для оценки сравнительной экономической эффективности способов получения водорода необходимо определить основные сопоставимые показатели: капиталовложения, годовые издержки производства и себестоимость единицы продукции, срок окупаемости дополнительных капиталовложений и приведенные затраты. Выполнение технико-экономических расчетов должно производиться с соблюдением определенных условий энергетической и экономической сопоставимости рассматриваемых вариантов как по объему производства, так и по методу расчета. При этом необходимо выполнять следующие требования:
- обеспечить одинаковый производственный эффект для потребителя водорода;
- учесть изменение затрат в смежных отраслях народного хозяйства (в том числе затрат на добычу и транспортировку сырья в сравниваемых условиях);
- оптимизировать каждый из сравниваемых вариантов по конструктивному исполнению и режиму эксплуатации;
- обеспечить единство методов расчетов для всех случаев выбора оптимального варианта (планирование, проектирование, эксплуатация, строительство, реконструкция и т. д.);
- представить экономические показатели, отражающие качественные и количественные характеристики каждого варианта, в стоимостном выражении;
- осуществить нахождение оптимального решения путем сопоставления ряда возможных по выполнению взаимозаменяемых результатов;
- использовать в качестве основного критерия оценки экономичности данного решения приведенные затраты или затраты за весь жизненный цикл с учетом фактора времени.
Необходимое количество тепловой энергии на производство 1 кг водорода рассчитывается в соответствии с химическими реакциями процессов генерации водорода. Для получения водорода в процессе электролиза расчет необходимой тепловой энергии выполнен применительно к атомной электростанции с моноблочным кипящим реактором типа «Бета» с коэффициентом полезного действия 30 %. Результаты расчетов приведены в таблице 1.7.
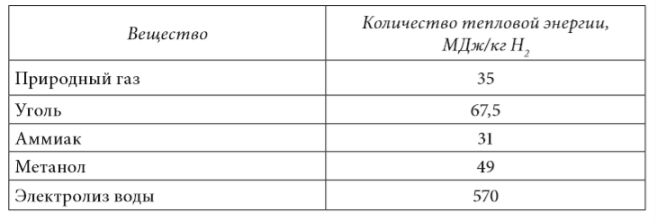
Приведенные в таблице 1.7 данные показывают, что углеводородное сырье и аммиак требуют для получения 1 кг водорода приблизительно одинаковое количество тепловой энергии. В то же время в процессе электролиза количество потребляемой энергии на порядок больше и существенно (более чем в 2,5 раза) превышает высшую теплоту сгорания водорода.
Использование ядерной энергетики для получения водорода
Для получения водорода характерны большие удельные затраты энергии. В процессах с использованием ископаемых топлив энергию получают сжиганием этих топлив — для осуществления технологии ПМК сжигается около половины используемого газа. Процессы электролиза потребляют в среднем 50 МВт электрической энергии на тонну водорода. При реализации термохимических циклов необходимы температуры порядка 1000 К, что требует существенных материальных затрат на производство водорода и результатом этого является отдаление перспективы широкомасштабного применения водорода в энергетике.
Изменить эту тенденцию может применение атомной энергетики для производства водорода. Ядерная технология обладает практически неограниченными ресурсами дешевой энергии для производства водорода, к тому же при производстве электричества, тепла и водорода ядерная энергетика оказывает наименьшее воздействие на окружающую среду в сравнении с использованием углеродных ресурсов.
Используя произведенное ядерной энергией электричество, можно, применив электролиз, разделить воду на водород и кислород. Если электролиз производить при помощи высокотемпературного пара, то полученная из ядерного реактора тепловая энергия может заменить часть электричества, и чистая эффективность (отношение произведенного водорода высокого нагрева (HHV) к затраченной электроэнергии) увеличится. При термохимических циклах разделения воды можно получать всю входную энергию от произведенного в ядерных реакторах тепла, используя комплексные, движимые тепловой энергией химические реакции разложения воды на кислород и водород, и давать эффективность ~50%.
Низкотемпературный электролиз
Этот метод является полностью доказанной коммерческой технологией, обеспечивающей сейчас 4% производства водорода в США. Установки электролиза коммерчески доступны, в них применяются три различные технологии — униполярные и биполярные ячейки, использующие водный раствор гидроокиси калия (щелочной электролиз), и ячейки с протонно-обменными мембранами (РЕМ электролиз). В крупных установках обычно применяют щелочную технологию. Доступны установки различной производительности — вплоть до ~1000 кг Н2 в день, и для увеличения объема производства подобные блоки можно соединять параллельно.
Установки большой производительности обычно работают при давлении, близком к атмосферному; полученный водород затем сжимается, чтобы достигнуть давления трубопровода (20–30 атмосфер). Разрабатываются установки с высоким давлением, что сделает ненужной компрессию водорода.
Предел чистой эффективности низкотемпературных систем электролиза, производящих водород при трубопроводных давлениях, составляет ~75%. Если подсоединить установку низкотемпературного электролиза к реактору LWR, производящему электроэнергию с 32%-м тепловым КПД, то чистая эффективность производства водорода составит 24%, а для усовершенствованного реактора с 48%-й тепловой эффективностью она будет равна 36%.
Потеря эффективности и увеличение кап. затрат при использовании двухступенчатого процесса преобразования высокотемпературного тепла в электричество с последующим использованием электричества для получения водорода — существенный негативный аспект низкотемпературного электролиза.
При типичных затратах на производство электричества и электролиз стоимость получаемого водорода высока: 4–6 долл./кг или больше. Полезный для применения в малых масштабах, этот способ не может конкурировать с технологией получения водорода из природного газа, где типичная стоимость водорода равна 1,00–1,50 долл./кг. Там, где доступны большие количества электричества по очень низкой цене, например на ГЭС, низкотемпературный электролиз вполне приемлем. Его можно легко и быстро запускать и останавливать, и с его помощью можно производить пригодный для хранения водород.
Низкотемпературный электролиз применим в ЯЭ, но только при наличии большого излишка мощностей. Сейчас энергетические компании удовлетворяют базовый спрос, используя АЭС и другие способы производства электроэнергии с низкими эксплуатационными расходами, а пиковые нагрузки покрывают, добавляя блоки, работающие на органическом топливе.
Последние имеют высокие топливные затраты, и их работу прекращают, когда они не нужны для покрытия спроса. Низкотемпературный электролиз мог бы играть роль в крупномасштабном ядерном производстве водорода, если бы энергетические компании имели больше ядерных мощностей, чем нужно для покрытия спроса на базовую электроэнергию, и могли перемещать выход электричества от сети к установкам электролиза в период низкого спроса на базовую электроэнергию.
Высокотемпературный электролиз
В этом методе пар с температурой ~800 °C разделяется так, что водород и кислород собираются на двух электродах (рисунок 1).
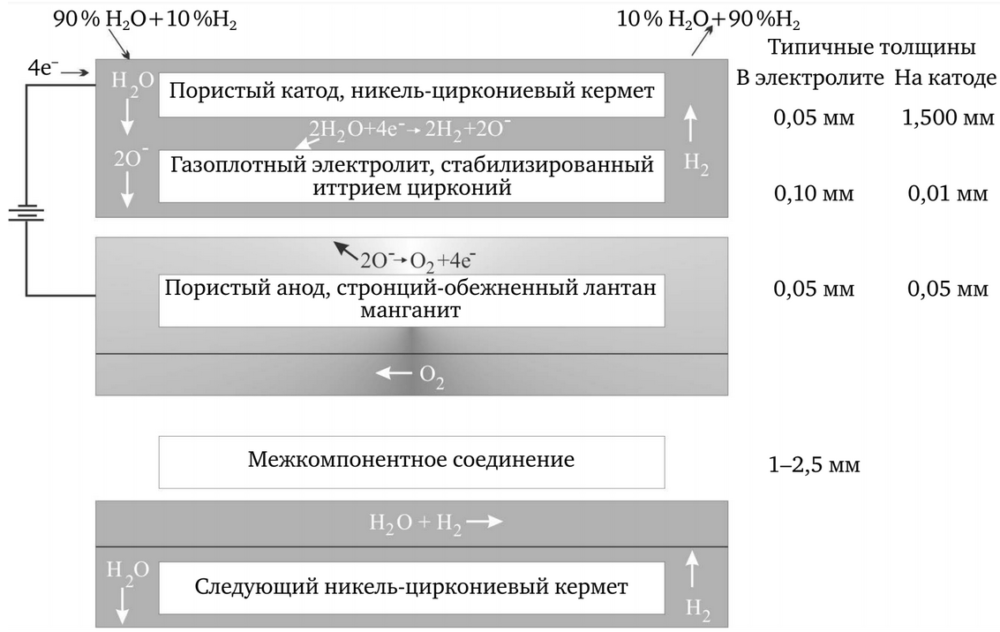
Эксплуатация ячейки при высоких температурах уменьшает количество электричества, нужного для производства водорода, так как около 30% энергии может вводиться в процесс в виде тепла, а не электричества. Кроме того, при температуре 800–1000 °C намного уменьшается сопротивление движению ионов кислорода через стабилизированный окисью иттрия или скандия циркониевый электролит, и все химические реакции протекают очень быстро. Наконец, эффективность производства электричества реактором, работающим при высокой температуре, значительно выше (около 45%). Комбинация этих эффектов может привести к полной эффективности водородного производства — 45–50%.
Процесс электролиза реализуют следующим образом. На одну из сторон плоской ячейки вводят пар и небольшое количество водорода (чтобы поддерживать изменяющееся состояние в катоде из двуокиси циркония и никеля).
Пар диффундирует на интерфейс между электродом и электролитом, где происходит первая реакция 2Н2О + e– → 2Н2 + 2О2–. Ионы кислорода несут электрический ток через твердый электролит к интерфейсу между электролитом и анодом, где происходит реакция 2О2– → O2 + e–. Связующая плата (ниже анода на рисунке 1) обеспечивает каналы потока для поступающей и уходящей пароводородной смеси, а также для кислорода, произведенного в аноде. Она также обеспечивает электрическое соединение ячейки со следующей. Кислород движется через анод из лантаново-стронциевого манганита (LSM), а паро-водородная смесь — по катоду на противоположной стороне электролита. При испытаниях (в октябре 2004 и январе 2005 гг.) экспериментальный комплект из десяти ячеек производил водород в виде газа (более 60 л/ч).
Idaho National Laboratory (INL) в сотрудничестве с фирмой Ceramatec исследует технические вопросы и проблемы увеличения масштаба, связанные с твердоокисным электролизом, пара. Результаты испытаний ячеек продемонстрировали эффективное производство водорода в небольших масштабах с рабочими характеристиками, близкими к теоретическим предсказаниям. Исходя из этих предварительных результатов, высокотемпературный электролиз считают жизнеспособным способом производства водорода с использованием ядерной энергии.
Термохимическое разложение воды
Термохимическое разложение воды — это преобразование воды в водород и кислород посредством ряда приводимых в действие теплотой химических реакций.
Как известно, для прямого термического разложения воды на водород и кислород требуется высокая температура на уровне 2500°С. Однако воду можно термически разложить и при более низкой температуре, около 1000oС, как этого требует термохимический процесс получения водорода с КПД до 50%.
В отличие от электролиза, энергия используется непосредственно, чтобы разложить соединения, содержащие водород. На отдельных стадиях процессов такого типа наряду с термическим воздействием для отщепления водорода может использоваться электричество (электролиз, плазма). Они называются гибридными термохимическими циклами или электротермо-химическими процессами.
Более высокая температура увеличивает скорость реакции и уменьшает количество этапов, необходимых для процесса. Температура, требуемая на каждом этапе, должна соответствовать подведенному теплу во избежание пустой траты энергии и материалов.
Тепловая энергия вводится в термохимический цикл через одну или более эндотермических высокотемпературных химических реакций. Для отвода энергии на выходе цикла используется одна или более экзотермических низкотемпературных реакций. Все реагенты, отличные от воды, восстанавливаются и вновь поступают в цикл.
Таким образом, термохимические и комбинированные циклы по получению водорода — это многостадийное разложение воды с помощью различных химических реакций. Этих способов известно несколько десятков тысяч, и каждый год появляется еще около пятидесяти. В сущности, термохимические циклы — это связывание воды, отщепление водорода и кислорода, регенерация реагентов:
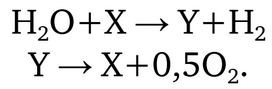
Реагенты X и Y, а в многостадийных способах используются и дополнительные вещества, определяют название циклов: галоидные, на основе металлов и их оксидов, на основе различных соединений углерода и циклы на основе серы.
В термохимических и комбинированных циклах с точки зрения экономики и экологии вряд ли оправдано использование соединений мышьяка, ртути, ванадия, стронция, цезия, брома, йода, даже если они перспективны в отношении термодинамики. Наиболее конкурентно способны циклы, в которых используются дешевые и легкодоступные реагенты: оксиды железа, серы, углерода, хлориды железа.
По массообмену методы делятся на замкнутые и разомкнутые, у первых в ходе реакций расходуется только вода, тепло и электроэнергия (если цикл комбинированный), у вторых, кроме перечисленных, расходуются реагенты (X, Y и др.), которые, из экономической целесообразности, являются промышленными отходами: сероводород, сернистый ангидрид, различные сульфиды, не полностью окислившиеся металлы.
Все современные промышленные методы получения водорода это разомкнутые термохимические циклы. Их характерная особенность заключается в том, что энергию, необходимую для разложения воды на водород и кислород, получают путем сжигания органического горючего; процесс получения водорода из воды сопровождается реакцией связывания кислорода углеродом горючего с образованием диоксида углерода (рисунок 2).
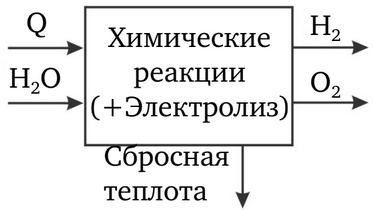
Недостатком такого открытого термохимического цикла является то, что в качестве отхода в окружающую среду выбрасывается диоксид углерода (на 1т водорода 10–50т диоксида углерода, в зависимости от технологии процесса и природы исходного горючего) (таблица 1).
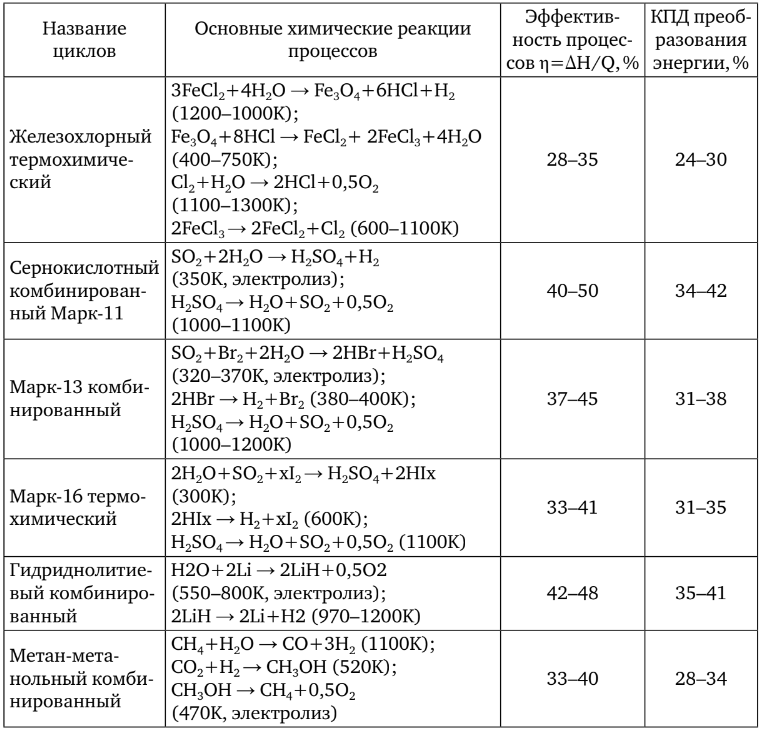
Эффективность рассчитывается по высшей теплоте сгорания водорода, КПД по низшей.
Химические элементы в термохимическом процессе используются снова и снова с очень малыми потерями или вообще без них. Основные условия — тепловая энергия и вода. В некоторых процессах электричество используется для электролиза в одном или нескольких этапах. Используемые химические элементы включают различные катализаторы, органические растворы, комплексные вещества и растворимые соли.
Цикл сульфата висмута
Цикл сульфата висмута, изобретенный Научной Лабораторией Los Alamos, был оценен за эффективность более чем 50% при 1000 °C (1800°F).
Процессу требуется меньшее количество серной кислоты, в отличии от других процессов. Это понижает напряжение для этапа электролиза (первый этап, показанный ниже). Коррозия также снижена. В ходе процесса используются твердые химические элементы.
2H2O + SО2 → H2SO4 + H2 комнатная температура
H2SO4 + Bi2О3 + SO3 → Bi2О3 ·2SO3 + H2O комнатная температура
Bi2О3 + 2SО3 → Bi2О3SО3 + SO3 800 °C
SO3 → SО2 + 1/2O2 свыше 800 °C.
На первом этапе вода и диоксид серы образуют водород и серную кислоту. Затем, серная кислота транспортируется в резервуар, который содержит Bi2О3 + SО3. Содержимое реагирует с серной кислотой, чтобы произвести Bi2О3·2SО3. Этот состав высушен и нагрет до 800°C (1500°F). В этом случае это соединение распадается на Bi2О3 + SО3 и трехокись серы. Трехокись серы нагревается до 800 °C, и распадается на диоксид серы и кислород. Диоксид серы охлаждается, отделяется и возвращается к электролиту.
Кислород в этом процессе может использоваться для производства железа и аэрации водоемов. Если кислорода произведено больше чем, нужно, он уходит в атмосферу.
Что касается других термохимических циклов, каждый вступает в выше упомянутый процесс — отдельную химическую реакцию, которая должна пройти так, чтобы требуемые количества полученных продуктов были доступны для следующего этапа, без отходов.
Цикл Вестингауза
Цикл Вестингауза имеет место при 300–375 °C (570–700°F).
SO2 + 2H2O → H2SO4 + H2 Комнатная температура
H2SO4 → H2О + SO2 + 1/2O2 800°C.
Как и в цикле висмута, первый этап включает электролиз воды, чтобы произвести серную кислоту и водород. Последняя реакция представляет простой распад молекулы серной кислоты при высокой температуре 1200°C (2190°F). Разложение 84% реагентов может произойти при 1080 °C (1976°F).
Компания General Atomics (GA), Sandia National Laboratories (SNL) и Университет Кентукки провели обзор мировой литературы по термохимическим, разлагающим воду циклам. Для детальной технической оценки из просмотренных 115 циклов отобрано 25 наиболее перспективных. В результате изучения химической термодинамики этих циклов и оценки предварительных технических диаграмм был отобран цикл «йод — сера» (IS) (рисунок 3).
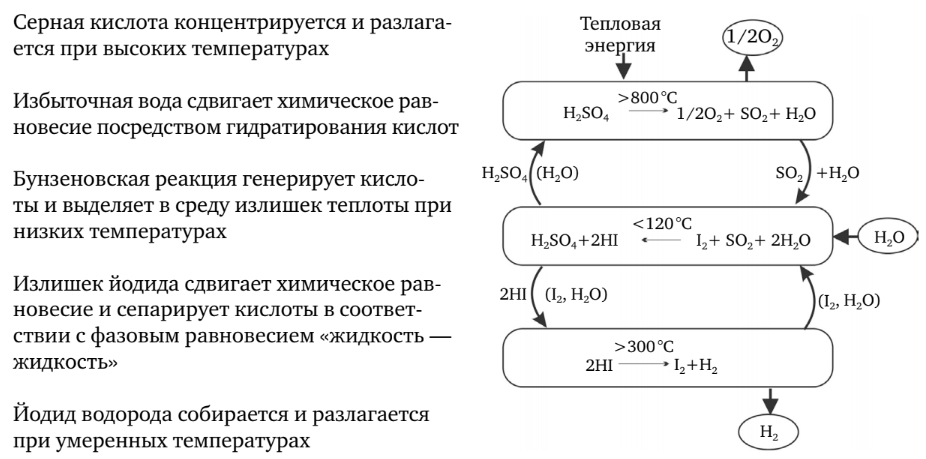
Цикл «йод — сера»
В цикле IS к воде добавляют йод и диоксид серы, что приводит к экзотермической реакции с образованием йодида водорода и серной кислоты. При надлежащих условиях эти вещества являются несмешивающимися и могут быть легко отделены. Серная кислота разлагается при 850 °C, высвобождая кислород и возвращая в оборот диоксид серы. Йодид водорода разлагается при температуре около 350 °C, высвобождая водород и возвращая в оборот йод. Конечный результат реакции — разложение воды на водород и кислород. На входе процесса требуются только вода и высокотемпературная тепловая энергия, а на выходе образуются водород, кислород и низкотемпературная тепловая энергия.
2H2O + I2 + SO2 → H2SO4 + 2HI комнатная температура
H2SO4 → H2O + SO2 + 1/2O2 300 °C
2HI → H2 + I2 800 °C.
В результате получается малое количество водорода и имеются трудности в отделении серной кислоты от йодида водорода, отходы отсутствуют.
Испытательные установки лабораторного масштаба для цикла IS с низким давлением успешно демонстрировались в Японском институте атомной энергии. Подготовку к лабораторным испытаниям при прототипных условиях по давлению и температуре в настоящее время совместно проводят GA, SNL и CEA-Saclay (рисунок 4).
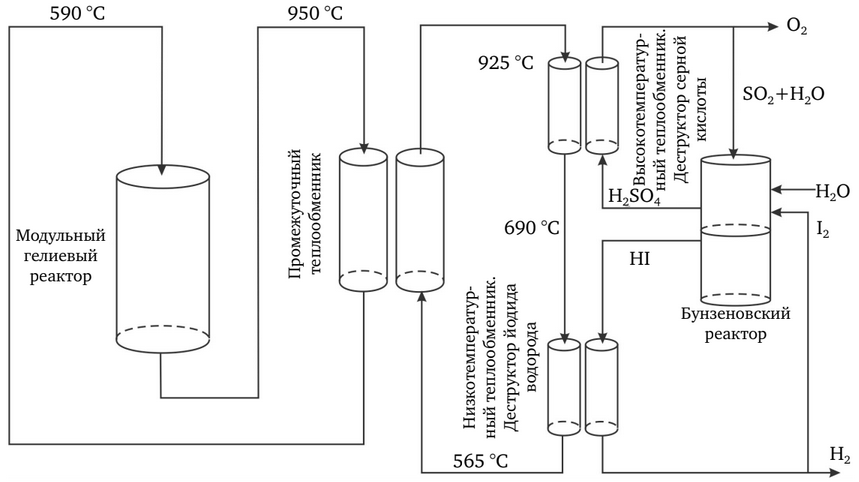
Цикл IS требует высоких температур, но предлагает высокую эффективность преобразования тепловой энергии в водород (рисунок 5). Главное преимущество состоит в том, что масштаб химических реакций определяется объемом, а не площадью электродов, как это имеет место при электролизе.
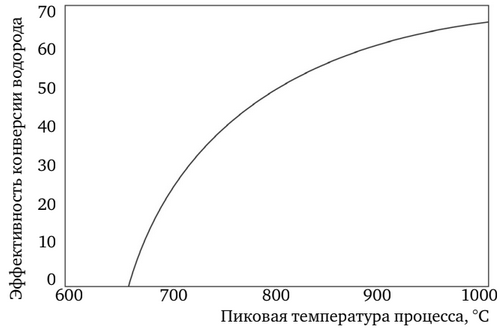
Таким образом, крупномасштабное производство водорода в ядерной энергетике должно обеспечить существенную экономию. Детальное изучение проекта указывает, что цикл IS, соединенный с модульным гелиевым реактором, мог бы производить водород по стоимости 1,50–2,00 долл./кг, что не намного больше текущей стоимости производства водорода из природного газа.
Ниже приведен другой процесс, исследованный в Los Alamos. В процессе не используется электролиз. Главный недостаток — высокие температуры.
Cd + CO2 + H2O → CdCО3 + H2 комнатная температура
CdCО3 → CdO + CО2 300 °C
CdO → Cd + 1/2 O2 свыше 1500 °C
Ученые сделали вывод, что самый многообещающий из четырех процессов — бром-серный цикл. В мае 1978 г. прошла демонстрация этого процесса. Он стал первым полным термохимическим процессом производства водорода разложением воды.
2H2O + Br2 + SO2 → H2SO4 + 2HBr
H2SO4 → H2О+ SO2 +1/2O2
2HBr → H2 + 2Br.
Серная кислота составляет 75% веса всей смеси. Кислота разложена при 90–1200°C и низком давлении 3 атм. Сталь используется в качестве катализатора. Нет необходимости в теплообменнике.
На третьем этапе, бромид водорода разлагается при напряжении 0,80 Вт. Получается 0,1 м3/ч водорода. Эти два газа легко отделяются, так как водород легче. Никакой сепаратор не требуется. Ниже приведена спецификация производства за 18 месяцев в течение 1984–1985 гг.
- Объем производимого водорода в час: 1000 м3/ч.
- Переработанная серная кислота: 43,7 кг/ч.
- Рабочее давление: 24,7 атм.
- Максимальная рабочая температура: 950 °C (1740°F).
- Требуемая электроэнергия: 100 кВт.
- Эффективность: 30–40%.
- Стоимость: 1,00 долл./м3/ч.
Эффективность и стоимость сравниваются с 28–32% высокотемпературного электролиза твердого полимера. Производство не выявило никаких неустойчивостей, никаких побочных продуктов, или посторонних реакций. Имеющихся знаний, химических технологий и коммерческих материалов достаточно для постройки Индустриальных экспериментальных заводов, никакой крупный технический прорыв не требуется… Термохимическое производство водорода выполнимо.
Процесс азотной кислоты
Ньювелл Кук разработал процесс переработки азотных окисей и кислоты, разлагая воду для производства водорода. Окись азота обладает низкой температурой кипения, низким потенциалом ионизации и высокой тепловой стабильностью. Множество кислот может использоваться вместо фосфорной кислоты.
2NO + 2HPО3 → 2NO+PO3–+ H2
Фосфорная кислота разлагается, выпуская водород и образуя фосфат азота. При добавлении воды получается кислота и половина азотной окиси. Выделяется теплота, NО2 нагревается, образуя NO, который используется повторно.
2NO + PO3–+ H2О → 2 НРО3 + NО + NО2
NО2 → NO + 1/2О2.
Окись азота распадается на положительный ион (NO+) и свободный электрон (e–). Этот процесс распада более эффективен, чем электролиз. Требуемая энергия — 58,2 Вт при 20°C (68°F) и 1 атм. В данном процессе выделяется небольшое количество водорода, но его проще осуществить, чем другие химические циклы.
Цикл «медь — хлор»
Возникший во время энергетического кризиса 1970-х гг. и иссякший вместе с ним интерес к термохимическим процессам возродился в последнее время, когда цены на органические топлива достигли рекордных отметок. Министерство энергетики США (DoE) вновь рассматривает некоторые из наиболее многообещающих ранних концепций, а также новые концепции, основанные на техническом прогрессе за прошлые 30 лет. Программа исследований DoE обращается к альтернативным термохимическим процессам, имеющим потенциал для достижения высоких показателей (высокая эффективность, низкие требования по температуре или уменьшенные сложность и коррозионная активность).
Альтернативные термохимические циклы могут работать при более низких температурах (около 550 °C), чем высокотемпературные циклы серы, требующие тепловой энергии с температурой свыше 825 °C. Циклы, работающие при более низких температурах, имеют два преимущества: меньшие требования к материалам и большая гибкость в отношении источников тепловой энергии.
Для соединения с низкотемпературными циклами пригодны следующие реакторы: сверхкритические водные реакторы типа Candu-Mark 2; усовершенствованный быстрый реактор с натриевым теплоносителем; высокотемпературный газовый реактор (HTGR), причем последний можно использовать для производства электричества с высоким КПД.
Argonne National Laboratory исследует потенциал низкотемпературного цикла Сu-Сl, состоящего из четырех главных реакций:
2CuCl → CuCl2 + Cu
2CuCl2 + H2 → Cu2OCl2 + 2HC
Cu2OCl2 → 2CuCl + 1/2O2
Cu + HCl → CuCl + 1/2H2.
Водород производится при 425 °C, а кислород — при 530 °C. Это самые высокие температуры в цикле. Кроме того, эти реакции включают генерацию либо газа и твердого вещества, либо жидкости. Их можно довести до завершения простым выпуском газа, минимизируя таким образом потоки переработки. Ввиду отсутствия конкурирующих реакций они идеально подходят для циклического процесса. Сейчас изучают промежуточные реакции, которые порождают большие проблемы. Привлекает комбинация относительно недорогих химикалий и высокой чистой эффективности — 49% (HHV). Хотя эта эффективность несколько ниже, чем в циклах серы, многообещающая химия заставляет признать, что цикл Сu-Сl имеет реальный потенциал. DoE спонсирует работу по оценке других, недостаточно изученных циклов, чтобы гарантировать себя от пропуска потенциально важных вариантов.
Гибридные циклы: HyS-цикл
Разлагающие воду циклы, которые включают по крайней мере один электрохимический шаг реакции, классифицируют как гибридные термохимические циклы. Наиболее известный и хорошо изученный из них — гибридный цикл серы, также известный как HyS-цикл, цикл серы Westinghouse, цикл Ispra Mark II или цикл GA 22 (рисунок 6). Все чисто термохимические циклы (типа IS) требуют по крайней мере трех отдельных шагов реакций. Гибридные циклы могут иметь только два шага. HyS-цикл имеет шаги: H2SО4 => SО2 + Н2О + 1/2 О2 и 2Н2О + SО2 => H2SО4 + Н2. Оба процесса — термохимические; первый протекает при температуре 800–900 °C, второй — при 100–120 °C.
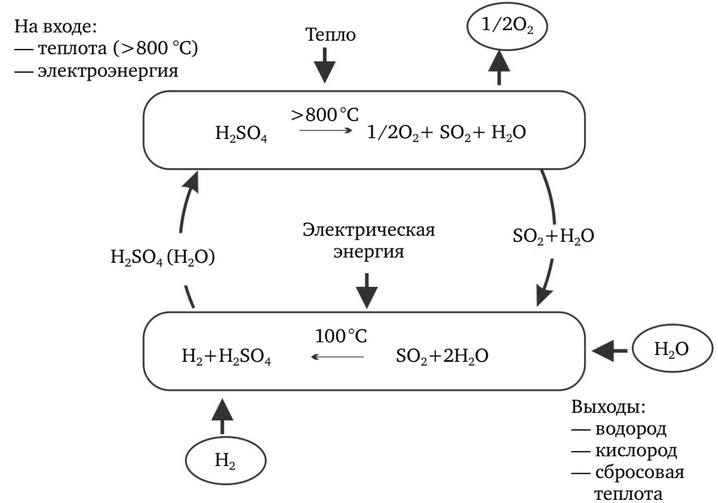
Присутствие SО2 на аноде электролизёра сильно уменьшает реверсивный потенциал ячейки, необходимый для расщепления молекул воды электролизом. Ввиду того что прямой электролиз воды имеет реверсивный потенциал ячейки 1,23 В при 25°C, теоретический потенциал для электролиза на аноде, деполяризованном SC>2, составит только 0,17В на ячейку. Практические SО2-электролизёры, как ожидается, будут потреблять в четыре раза меньше электроэнергии, чем обычные электролизёры.
При объединении с эндотермическим разложением H2SО4 чистые потребности в тепловой энергии для HyS-цикла значительно меньше, чем для прямого электролиза воды. Проблема состоит в разработке такого процесса, который максимизировал бы преимущество в тепловой эффективности при минимизации его сложности и капзатрат.
Недавняя работа Национальной лаборатории Savannah River (SRNL) привела к усовершенствованию процесса в HyS-цикле. Был проведен анализ технологической схемы HyS-системы, объединенной с охлаждаемым гелием ядерным реактором. Расчетная чистая тепловая эффективность установки составила 48,8 % при температуре на входе в процесс, равной 900°C.
Разработка деполяризованного SО2-электролизёра, соответствующего заданным рабочим параметрам, имеющего долгий срок эксплуатации и эффективного по затратам, является основной целью продолжающихся исследований. SRNL разрабатывает электролизёр на основе РЕМ-электролиза. Уникальные условия SО2 электролиза, такие, как необходимость иметь дело с серной кислотой и растворенным SО2, делают такую разработку трудной задачей. Разработка дешевого электролизёра — ключевой фактор в получении эффективного по затратам HyS-цикла.
Предварительный экономический анализ, сделанный на основе разумной экстраполяции прогнозных значений стоимости РЕМ-электролизёра, показывает, что HyS-цикл в комбинации с охлаждаемым гелием газовым реактором мог бы производить водород при затратах ~1,60 долл./кг, что примерно соответствует затратам процесса IS. Дополнительные доходы от продажи побочного продукта (кислорода) могут уменьшить издержки.
Технические проблемы включают оптимизацию эксплуатационных режимов (температура, давление, кислотная концентрация), материалы для строительства, проект ячейки (в том числе, выбор мембраны и нагрузки электрокатализатора), а также долговечность и рабочие характеристики.
Другие технические вопросы связаны с секцией разложения серной кислоты и системой разделения SО2/О2. Следующим шагом является демонстрационная замкнутая петля полного HyS цикла, включая электролизёр и секции разложения кислоты.
Затраты
Химические элементы в термохимическом процессе используются снова и снова с очень малыми или вообще без потерь. Основные условия — тепловая энергия и вода. В некоторых процессах электричество используется для электролиза в одном или нескольких этапах. Используемые химические элементы включают различные катализаторы, органические растворы, комплексные вещества и растворимые соли.
Для сравнения альтернативных процессов, нужно рассмотреть экономические затраты. Стоимость высокотемпературного электролиза с твердыми полимерными электролитами сравнима со стоимостью лучших термохимических циклов. Газификация угля, однако, остается наиболее дешевым источником водорода. Переход к электролизу или термохимическим циклам достаточно длительный и дорогостоящий процесс.
В таблице 2 приведены сравнительные затраты различных коммерческих и экспериментальных способов производства водорода.
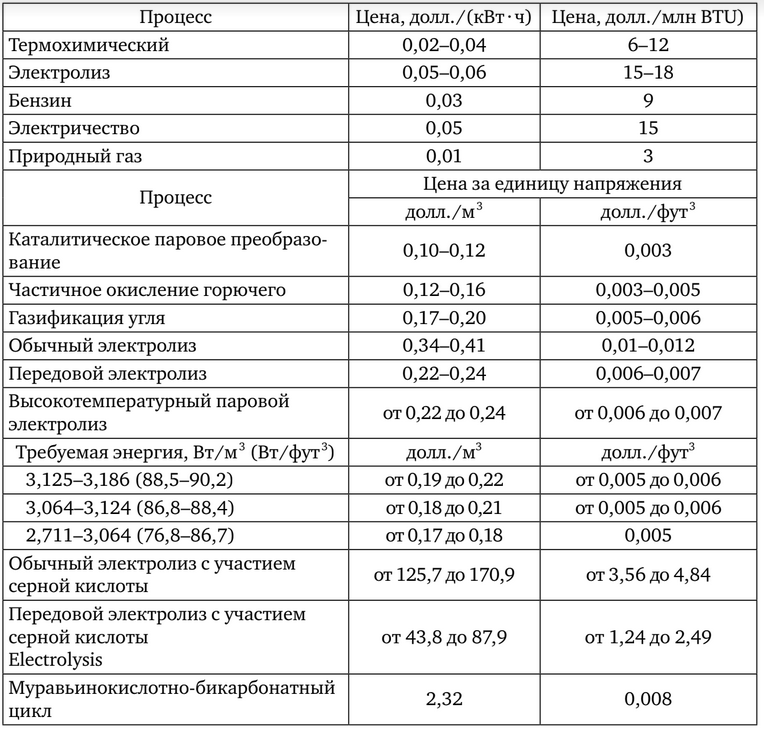
Было изучено более чем 1000 возможных термохимических циклов, использующих материалы, которые могут быть переработаны. В ходе процесса с участием углеводорода были переработаны все материалы. Единственными материалами для любого термохимического цикла были вода, высокая температура и электричество. Ученые сделали вывод, что самый многообещающий — бром-серный цикл.
Что касается затрат на эти термохимические процессы, то наблюдения «L.P. Bicelli» являются пессимистическими. «Вследствие многих проблем, трудно предсказать, будет ли один из этих процессов производства водорода, которые являются чрезвычайно сложными с технической точки зрения, когда-либо использоваться в коммерческих целях».